Hvordan træner du halvdelen af koncentrationer?
Her er hvorfor og hvordan man nærmer sig relaterede koncepter:
Forståelse af halveringstid:
* Radioaktivt forfald: Halveringstiden for en radioaktiv isotop er den tid, det tager for halvdelen af de radioaktive atomer i en prøve for at henfalde. Det er en fast værdi for hver specifik isotop.
* Førsteordens reaktioner: I kemiske reaktioner kan en halveringstid defineres for reaktioner, der følger førsteordens kinetik. Disse reaktioner fortsætter med en hastighed, der er direkte proportional med koncentrationen af reaktanten.
Hvorfor halveringstid gælder ikke for koncentrationer:
* Koncentration er ikke en egenskab for et stof: Koncentration er et mål for, hvor meget af et stof der er til stede i et givet volumen. Det er ikke en iboende egenskab for selve stoffet.
* Koncentration ændres med tiden: I de fleste scenarier ændres koncentrationer over tid på grund af processer som reaktioner, diffusion eller fortynding. Disse ændringer styres ikke af en fast halveringstid som radioaktivt forfald.
Sådan håndteres koncentrationsændringer:
1. sats love: For reaktioner bruger du hastighedslove til at beskrive, hvordan koncentrationen ændrer sig over tid. Renteloven afhænger af reaktionens rækkefølge.
2. Integrerede sats love: Du kan udlede integrerede sats love fra satsens love. Disse ligninger relaterer koncentrationen til tiden.
3. For første ordens reaktioner er halveringstiden:
* t 1/2 =0,693 / k (hvor k er hastighedskonstanten)
Eksempel:
Forestil dig, at du har en løsning med en indledende koncentration af en reaktant, og den gennemgår en første ordens reaktion. Du kan bruge den integrerede hastighedslov til at bestemme koncentrationen på et givet tidspunkt eller bruge halveringstiden til at beregne, hvor lang tid det tager for koncentrationen at falde med halvdelen.
Nøglepunkt: Forvirr ikke halveringstid med andre koncepter relateret til koncentrationsændringer. Det er specifikt for radioaktivt forfald og førsteordens reaktioner.
 Varme artikler
Varme artikler
-
 Bygger næste generations smarte materialer med lydens kraftEn akustisk skabt MOF, med mikrochippen, der producerede de højfrekvente lydbølger, der blev brugt i processen. Kredit:RMIT University Forskere har brugt lydbølger til præcist at manipulere atomer
Bygger næste generations smarte materialer med lydens kraftEn akustisk skabt MOF, med mikrochippen, der producerede de højfrekvente lydbølger, der blev brugt i processen. Kredit:RMIT University Forskere har brugt lydbølger til præcist at manipulere atomer -
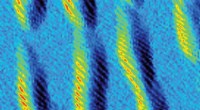 Polymerer klikker sammen ved hjælp af grøn kemiDisse fjederlignende strukturer er spiralformede polymerer. De spiralformede spoler er angivet med lyse striber i dette sidebillede af de små molekylestore tråde, der ligger på en overflade. Et team a
Polymerer klikker sammen ved hjælp af grøn kemiDisse fjederlignende strukturer er spiralformede polymerer. De spiralformede spoler er angivet med lyse striber i dette sidebillede af de små molekylestore tråde, der ligger på en overflade. Et team a -
 Designerbakterier producerer koralantibiotikaHornkoraller af arten Antillogorgia elisabethae producerer antibiotiske naturlige stoffer. Et forskerhold på TUM har med succes produceret et af disse stoffer i laboratoriet. Kredit:Thomas Brück/TUM
Designerbakterier producerer koralantibiotikaHornkoraller af arten Antillogorgia elisabethae producerer antibiotiske naturlige stoffer. Et forskerhold på TUM har med succes produceret et af disse stoffer i laboratoriet. Kredit:Thomas Brück/TUM -
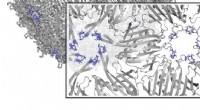 Afsløring af reglerne bag virusstilladskonstruktionForskere brugte en teknik kaldet SyMAPS til at analysere flere aminosyreændringer i MS2-viruspartiklen. Kredit:Northwestern University Et team af forskere, herunder Northwestern Engineering-fakult
Afsløring af reglerne bag virusstilladskonstruktionForskere brugte en teknik kaldet SyMAPS til at analysere flere aminosyreændringer i MS2-viruspartiklen. Kredit:Northwestern University Et team af forskere, herunder Northwestern Engineering-fakult
- Hurtig og fleksibel beregning af optisk diffraktion
- Hvad er der bag en nr. 1-placering? Open-source LineUp-software muliggør granulær analyse af subje…
- Elektrolyseceller med fast oxid letter CO2-elektrolyse under intermitterende vedvarende energienergi
- Minimalistiske maskinlæringsalgoritmer analyserer billeder fra meget få data
- Uran afslører sin sande natur
- Hvordan en politikontakt fra ungdomsskolen fører til forskellige resultater for sorte, hvide unge


