Afsløring af reglerne bag virusstilladskonstruktion
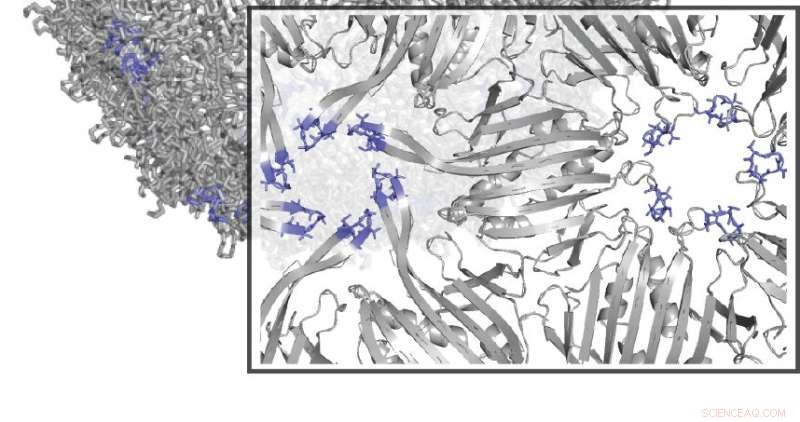
Forskere brugte en teknik kaldet SyMAPS til at analysere flere aminosyreændringer i MS2-viruspartiklen. Kredit:Northwestern University
Et team af forskere, herunder Northwestern Engineering-fakultetet, har udvidet forståelsen af, hvordan virusskaller selv samler sig, et vigtigt skridt i retning af at udvikle teknikker, der bruger vira som vehikler til at levere målrettede lægemidler og terapeutika i hele kroppen.
Ved at udføre flere aminosyresubstitutioner, forskerne opdagede tilfælde af epistase, et fænomen, hvor to ændringer producerer en adfærd, der er forskellig fra den adfærd, som hver ændring forårsager individuelt.
"Vi fandt hændelser, hvor to separate enkelte aminosyreændringer fik virusskallen til at knække eller blive virkelig ustabil, men at lave begge ændringer sammen gav en stabil struktur, der fungerede bedre end nogensinde, " sagde Danielle Tullman-Ercek, lektor i kemisk og biologisk ingeniørvidenskab ved McCormick School of Engineering.
Artiklen med titlen "Eksperimentel evaluering af coevolution i en selvsamlende partikel, " blev udgivet den 19. marts trykte udgave af Biokemi . Tullman-Ercek fungerede som avisens medkorresponderende forfatter sammen med samarbejdspartner Matthew Francis, professor i kemi ved University of California i Berkeley.
Arbejdet bygger på tidligere forskning, hvor Tullman-Ercek og samarbejdspartnere udviklede en ny teknik, kaldet SyMAPS (Systematic Mutation and Assembled Particle Selection), at teste variationer af et protein, der bruges af en bakterievirus kaldet MS2-bakteriofagen. Ved at erstatte aminosyrer en ad gangen langs MS2-proteinkæden, holdet kunne studere, hvordan virusstilladset blev påvirket af de forskellige kombinationer, herunder hvilke ændringer, der har bevaret skallens struktur eller brudt den fra hinanden.
Den seneste forskning bygger på holdets fremskridt ved at bruge SyMAPS til at analysere flere aminosyreændringer i MS2-partiklen, et krav om effektivt at manipulere virusskaller i fremtiden, sagde Tullman-Ercek. Forskere undersøgte hver dobbelt aminosyrekombination langs en polypeptidløkke placeret i MS2-stilladset og målte, hvordan virus-stilladset blev påvirket.
En faktor, der producerede epistase, var at balancere de aminosyreladninger, der blev erstattet, sagde Tullman-Ercek, medlem af Northwesterns Center for Synthetic Biology. Udskiftning af to positivt ladede aminosyrer, for eksempel, fik partiklen til at frastøde og gå i stykker, men balancering af en enkelt positiv aminosyreændring med en separat negativ ladning kompenserede skiftet og bevarede stabiliteten.
"Det lignede en uforudsigelig effekt, men hvis du ser på de overordnede tendenser i dataene, vi lærte, at ladning er virkelig vigtig for at bevare balancen, " sagde Tullman-Ercek. "Vi kunne ikke se det baseret på de data, vi akkumulerede med de enkelte ændringer, men vi blev ved med at vende tilbage til dette problem med afgiftsbalancering."
Holdet planlægger at udvide testene for at afgøre, om den adfærd, der findes i MS2-partiklen, gælder for lignende vira.
"Det tager år at optimere hver komponent i et virusstillads, "Tullman-Ercek sagde. "Vi forsøger at reducere den tid, det tager at optimere leveringskøretøjet ved at lære reglerne for, hvordan det samles, så vi til sidst kan bygge en fra bunden."
Afhængigt af dets formål eller endelige destination i kroppen, virusstilladser kræver unikke designegenskaber. En virus indsat i hjernen for at behandle en tumor, for eksempel, kan have brug for større stabilitet i sin form end en sendt til lungerne. Jo mere generelle reglerne for design er, den større variation af partikler kan konstrueres og anvendes i fremtiden.
"Hvis vi skal optimere leveringskøretøjet til hver enkelt sag, det vil tage årtier at gøre fremskridt, så det er vigtigt at finde ud af de underliggende regler, " sagde hun. "Det er et grundlæggende videnskabeligt projekt, men det har potentialet til virkelig at påvirke designet af en masse fremtidige terapier."
Indsigten fik også holdet til at stille spørgsmålstegn ved, hvordan deres strategi kan kombineres med det, der allerede er kendt - og ukendt - om evolution.
"I evolutionen, ændringer bygger på hinanden én ad gangen, " sagde Tullman-Ercek. "Vi foretager disse ændringer bevidst i vores laboratorium, hvilket får dig til at spekulere på, hvordan naturen når disse epistatiske tilstande med kombinationer, der ville producere negative resultater alene. Vi ønsker at bygge dette til lægemiddellevering, men resultaterne rejser interessante spørgsmål om, hvordan ændringer optimeres i naturen til at begynde med."
 Varme artikler
Varme artikler
-
 Lad solen skinne ind:Selvrensende membran under synlig lysbehandlingDen hydrofile fotokatalytiske membran udviste fremragende antimikrobiel aktivitet under synligt lys, og den anti-biobegroningsegenskab muliggjorde en fuldstændig fluxgenvinding af membranen i gentagne
Lad solen skinne ind:Selvrensende membran under synlig lysbehandlingDen hydrofile fotokatalytiske membran udviste fremragende antimikrobiel aktivitet under synligt lys, og den anti-biobegroningsegenskab muliggjorde en fuldstændig fluxgenvinding af membranen i gentagne -
 Forskere syntetiserer gipserstatningNaturlig gipssten. Kredit:Maksim Safaniuk Et internationalt hold af videnskabsmænd har foreslået en metode til fremstilling af højkvalitets gipsbindemidler baseret på syntetisk calciumsulfatdihydr
Forskere syntetiserer gipserstatningNaturlig gipssten. Kredit:Maksim Safaniuk Et internationalt hold af videnskabsmænd har foreslået en metode til fremstilling af højkvalitets gipsbindemidler baseret på syntetisk calciumsulfatdihydr -
 Team rapporterer diamantringarkitektur af et proteinkompleksNuA4 cryo-EM-strukturen ligner en diamantring. Kredit:USTC NuA4/Tip60, et kompleks med diamantringarkitektur, er påkrævet for lovgivnings- og reparationsprocesser. Prof. CAI Gang og Prof. Jacques
Team rapporterer diamantringarkitektur af et proteinkompleksNuA4 cryo-EM-strukturen ligner en diamantring. Kredit:USTC NuA4/Tip60, et kompleks med diamantringarkitektur, er påkrævet for lovgivnings- og reparationsprocesser. Prof. CAI Gang og Prof. Jacques -
 Et kort over reaktioner hjælper med at kontrollere molekylære egenskaberKredit:University of Michigan Kemiske reaktioner bruges til at producere alle slags vigtige molekyler såsom lægemidler, landbrugskemikalier og materialer. At skabe et lægemiddel med specifikke eg
Et kort over reaktioner hjælper med at kontrollere molekylære egenskaberKredit:University of Michigan Kemiske reaktioner bruges til at producere alle slags vigtige molekyler såsom lægemidler, landbrugskemikalier og materialer. At skabe et lægemiddel med specifikke eg
- Frø af verdens sjældneste træer og afgrøder kan ikke bankes
- Sådan rundes du til det største sted Value
- Ny type supercomputer kunne være baseret på en magisk støvkombination af lys og stof
- Trick for Learning 3 Times Tables
- Længe ventet anmeldelse afslører vandets rejse fra interstellare skyer til beboelige verdener
- Verden protesterer, da Amazonas skove åbnes for minedrift


