Hvordan er den kemiske stabilitet af et mineral påvirket af bindingsatomer i mineralet?
1. Obligationstype:
* ionisk binding: Mineraler med stærke ioniske bindinger (som Halite, NaCl) er generelt mere stabile end dem med svagere ioniske bindinger. Ioniske bindinger dannes af den elektrostatiske tiltrækning mellem modsat ladede ioner, hvilket skaber en stærk, stiv gitterstruktur.
* kovalent binding: Mineraler med kovalente bindinger (som Diamond, C) er meget stabile på grund af deling af elektroner mellem atomer, hvilket skaber en meget stærk og stiv struktur.
* Metallisk binding: Mineraler med metallisk binding (som native kobber, Cu) er mindre stabile end dem med ioniske eller kovalente bindinger. Metalliske bindinger involverer et "hav" af delokaliserede elektroner, hvilket gør dem mere formbare og ledende, men også mindre resistente over for kemiske reaktioner.
2. Obligationsstyrke:
* stærkere obligationer: Mineraler med stærkere bindinger er mere modstandsdygtige over for kemisk forvitring og opløsning. Dette skyldes, at det at bryde obligationerne kræver en større mængde energi.
* svagere obligationer: Mineraler med svagere bindinger er mere modtagelige for kemisk forvitring og nedbrydning.
3. Obligationspolaritet:
* polære obligationer: Mineraler med polære bindinger (hvor elektroner deles ujævnt, hvilket skaber delvise ladninger) er mere modtagelige for interaktioner med polære molekyler som vand. Dette kan føre til opløsning eller ændring.
* Ikke-polære bindinger: Mineraler med ikke-polære bindinger (hvor elektroner deles jævnt) er mindre modtagelige for interaktioner med polære molekyler.
4. Obligationslængde og vinkel:
* korte obligationer: Mineraler med kortere bindinger mellem atomer er generelt mere stabile på grund af stærkere elektrostatisk tiltrækning.
* Optimale vinkler: Vinklerne mellem bindinger kan påvirke den samlede stabilitet af krystalstrukturen. Afvigelse fra de ideelle vinkler kan svække strukturen.
5. Koordinationsnummer:
* Højere koordinering: Mineraler med højere koordinationsnumre (antallet af atomer omkring et centralt atom) har en tendens til at være mere stabile på grund af større elektrostatisk interaktion.
Eksempler:
* kvarts (SiO2): De stærke kovalente bindinger mellem silicium og ilt gør det ekstremt stabilt og modstandsdygtigt over for forvitring.
* Calcite (CACO3): Selvom det har ioniske bindinger, gør dens relativt svagere bindinger sammenlignet med kvarts det mere modtageligt for opløsning ved sure opløsninger.
* pyrite (FES2): De stærke kovalente bindinger inden for pyrit gør det meget modstandsdygtigt over for forvitring, hvilket fører til dens bevarelse i mange geologiske miljøer.
Kortfattet:
Den kemiske stabilitet af et mineral er et komplekst samspil mellem disse bindingsfaktorer. Mineraler med stærke, ikke-polære bindinger, korte bindingslængder, optimale vinkler og højere koordinationsnumre er generelt mere kemisk stabile. Imidlertid spiller andre faktorer som tryk, temperatur og tilstedeværelsen af reaktive væsker også en afgørende rolle i bestemmelsen af mineralstabilitet.
Sidste artikelNår ilt ikke er til stede, hvad fungerer der?
Næste artikelHvad er hovedfunktionen i videnskabelig proces-?
 Varme artikler
Varme artikler
-
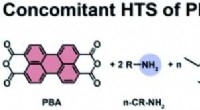 Teamet bruger varmt vand til at danne fotokatalysatorSyntese af n-alkyl-PBI i nærvær af TEOS (n =1, 5, 10 og 100 ækv.). R =n-propylamin (C3), n-pentylamin (C5), n-octylamin (C8), n-tetradecylamin (C14). Kredit:Hipassia M. Moura et al., Journal of Materi
Teamet bruger varmt vand til at danne fotokatalysatorSyntese af n-alkyl-PBI i nærvær af TEOS (n =1, 5, 10 og 100 ækv.). R =n-propylamin (C3), n-pentylamin (C5), n-octylamin (C8), n-tetradecylamin (C14). Kredit:Hipassia M. Moura et al., Journal of Materi -
 At se kemiske reaktioner med musik(Top) Lydkontrollerede spatiotemporale mønstre. Skematisk repræsentation af eksperimentel opsætning brugt til lydstyret spatiotemporal mønstergenerering. For mønstergenereringseksperimenter, O2-følsom
At se kemiske reaktioner med musik(Top) Lydkontrollerede spatiotemporale mønstre. Skematisk repræsentation af eksperimentel opsætning brugt til lydstyret spatiotemporal mønstergenerering. For mønstergenereringseksperimenter, O2-følsom -
 Mystisk organisk skum øger effektiviteten af kemiske reaktioner, kan reducere kemisk affaldIllinois-forskere er en del af et multiinstitutionelt team, der fandt ud af, at opløsningsmidler spontant reagerer med metal-nanopartikler for at danne reaktive komplekser, der kan forbedre katalysato
Mystisk organisk skum øger effektiviteten af kemiske reaktioner, kan reducere kemisk affaldIllinois-forskere er en del af et multiinstitutionelt team, der fandt ud af, at opløsningsmidler spontant reagerer med metal-nanopartikler for at danne reaktive komplekser, der kan forbedre katalysato -
 Petrovite:Forskere opdager et nyt mineral i KamchatkaPetrovit. Kredit:SPbU I mere end 40 år, forskere har studeret mineralogien af scoria-kegler og lavastrømme af fumaroler i Kamchatka. Funktionerne blev dannet efter to store udbrud af Tolbachik-v
Petrovite:Forskere opdager et nyt mineral i KamchatkaPetrovit. Kredit:SPbU I mere end 40 år, forskere har studeret mineralogien af scoria-kegler og lavastrømme af fumaroler i Kamchatka. Funktionerne blev dannet efter to store udbrud af Tolbachik-v
- Kunne militærstrategi vinde krigen mod global opvarmning?
- Nye nanokompositfilm øger varmeafledningen i tynd elektronik
- Opklaring af et mysterium omkring kosmisk stof
- Sådan beregnes mængden af et pulver Mixture
- Libanon -dæmningen planlagt oven på fejllinjen vækker frygt
- Astronomer fanger stjernevinde med hidtil usete detaljer


