Ændringer fra en væske til fast?
Her er hvad der sker:
* faldende temperatur: Den mest almindelige måde for en væske at blive et fast stof er ved at afkøle den. Når temperaturen falder, mister molekylerne i væsken kinetisk energi (bevægelsesenergi).
* Nedsat afstand og øget rækkefølge: Molekylerne bremser ned, og deres gennemsnitlige afstand fra hinanden falder. De bliver mere tæt pakket og arrangerer sig i en mere ordnet struktur.
* faste positioner: I et fast stof er molekylerne låst i specifikke positioner. De kan vibrere, men de kan ikke bevæge sig frit, som de gør i en væske.
Her er en simpel analogi:Forestil dig et rum fuld af mennesker, der danser. Dette er som en væske, hvor folk bevæger sig frit. Hvis alle pludselig holder op med at danse og står stille, bliver de mere organiserede og mindre mobile, ligesom molekyler i et fast stof.
Her er nogle nøglepunkter at huske:
* frysningspunkt: Temperaturen, hvormed en væske ændrer sig til et fast stof.
* Krystallisation: Mange faste stoffer dannes i en meget ordnet, gentagne struktur kaldet en krystalgitter.
* amorfe faste stoffer: Nogle faste stoffer, som glas, har ikke en almindelig krystalstruktur. Deres molekyler er mere tilfældigt arrangeret.
Fortæl mig, hvis du gerne vil vide mere om ethvert specifikt aspekt af fryseprocessen!
Sidste artikelHvad er ionisk gel i kemi?
Næste artikelHvilken kemisk ændring, der producerer lys og varme?
 Varme artikler
Varme artikler
-
 Selvfoldende origami:Kemisk programmering gør det muligt for Nafion-ark at folde og folde igenKredit:Wiley Plast med tusinde flader:Et enkelt stykke Nafion-folie gør det muligt at fremstille en bred palet af komplekse 3D-strukturer. I journalen Angewandte Chemie , forskere beskriver, hvo
Selvfoldende origami:Kemisk programmering gør det muligt for Nafion-ark at folde og folde igenKredit:Wiley Plast med tusinde flader:Et enkelt stykke Nafion-folie gør det muligt at fremstille en bred palet af komplekse 3D-strukturer. I journalen Angewandte Chemie , forskere beskriver, hvo -
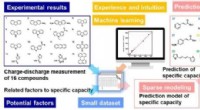 Bedste ydeevne af organisk materiale til lithiumbatterianode ved brug af materialeinformatikAccelereret opdagelse af højtydende organisk anode baseret på eksperimentorienteret MI. Kredit:© Yuya Oaki På JST Strategic Basic Research Programs, forskningsgruppen ledet af lektor Yuya Oaki og
Bedste ydeevne af organisk materiale til lithiumbatterianode ved brug af materialeinformatikAccelereret opdagelse af højtydende organisk anode baseret på eksperimentorienteret MI. Kredit:© Yuya Oaki På JST Strategic Basic Research Programs, forskningsgruppen ledet af lektor Yuya Oaki og -
 Kemikere udvikler kontaminantdetekteringsteknik for heparinJason Dwyer, lektor i kemi, taler med James Hagan, fra Nashua, N.H., en doktorand i Dwyers forskningsgruppe, og gymnasieelev Anna Khabaeva, fra Cranston, der er på et forskningsstipendium. Kredit:Mich
Kemikere udvikler kontaminantdetekteringsteknik for heparinJason Dwyer, lektor i kemi, taler med James Hagan, fra Nashua, N.H., en doktorand i Dwyers forskningsgruppe, og gymnasieelev Anna Khabaeva, fra Cranston, der er på et forskningsstipendium. Kredit:Mich -
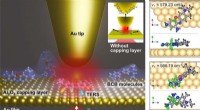 Iagttagelse af forskellen i strukturel dynamik af 1 nm enkeltmolekyler ved stuetemperatur for først…(Venstre) Illustration af isolerede molekyler fanget mellem guld- og aluminiumoxidlag ved hjælp af en spidsforstærket nanoskopi. (Højre) Visualisering af vibrationstilstandene for et brillant cresylbl
Iagttagelse af forskellen i strukturel dynamik af 1 nm enkeltmolekyler ved stuetemperatur for først…(Venstre) Illustration af isolerede molekyler fanget mellem guld- og aluminiumoxidlag ved hjælp af en spidsforstærket nanoskopi. (Højre) Visualisering af vibrationstilstandene for et brillant cresylbl
- Kuldioxidniveauer og klimaændringer:Er der virkelig en kontrovers?
- Sådan beregnes trefasestyrke
- Det britiske firma i Facebook-rækken suspenderer CEO efter nye afsløringer
- Shadow-netværk holder samfund sikre mod dødbringende vulkan
- Forskere finder en måde at forbedre ydeevnen af kvantecomputere
- Virtual reality kan motivere folk til at donere til flygtningekriser uanset politik


