Hvilket stof har den største fordampningsvarme er det F2 Cl2 Br2 O2 I2?
Her er hvorfor:
* fordampningsvarme: Dette er den mængde energi, der kræves for at ændre et stof fra en væske til en gas ved dets kogepunkt.
* Intermolekylære kræfter: Styrken af intermolekylære kræfter mellem molekyler bestemmer den mængde energi, der er nødvendig for at bryde dem fra hinanden under fordampning. Stærkere intermolekylære kræfter fører til højere fordampningsvarme.
* London Dispersion Forces: Den primære intermolekylære kraft i disse diatomiske molekyler er London -spredningskræfter. Disse kræfter øges med stigende molekylær størrelse og polariserbarhed.
jod (i2) er det største molekyle på listen, hvilket gør det til den mest polariserbare. Dette betyder, at det har de stærkeste London -spredningskræfter, der fører til den højeste fordampningsvarme.
Kortfattet:
* i2> br2> cl2> f2> o2 (Øget fordampningsvarme)
 Varme artikler
Varme artikler
-
 Ingeniører udvikler smart materiale, der ændrer stivhed, når det drejes eller bøjesEksempler på det nye smarte materiale, venstre mod højre:En fleksibel strimmel; en fleksibel strimmel, der stivnede, når den blev snoet; en fleksibel strimmel omdannet til en hård komposit, der kan ho
Ingeniører udvikler smart materiale, der ændrer stivhed, når det drejes eller bøjesEksempler på det nye smarte materiale, venstre mod højre:En fleksibel strimmel; en fleksibel strimmel, der stivnede, når den blev snoet; en fleksibel strimmel omdannet til en hård komposit, der kan ho -
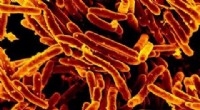 Forskere opdager en potentiel metode til at udsulte de bakterier, der forårsager tuberkuloseScanningselektronmikrofotografi af Mycobacterium tuberculosis bakterier, som forårsager TB. Kredit:NIAID Infektionssygdommen tuberkulose (TB) er en af de førende dødsårsager på verdensplan. Mens
Forskere opdager en potentiel metode til at udsulte de bakterier, der forårsager tuberkuloseScanningselektronmikrofotografi af Mycobacterium tuberculosis bakterier, som forårsager TB. Kredit:NIAID Infektionssygdommen tuberkulose (TB) er en af de førende dødsårsager på verdensplan. Mens -
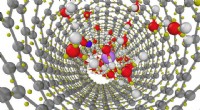 Indkredsning af virkningerne af nanoindeslutning på vandStruktur af en lithiumchloridopløsning indespærret i et 1,1 nanometer diameter carbon nanorør som opnået fra første principper molekylær dynamik simuleringer. Billede af Viktor Rozsa/University of Chi
Indkredsning af virkningerne af nanoindeslutning på vandStruktur af en lithiumchloridopløsning indespærret i et 1,1 nanometer diameter carbon nanorør som opnået fra første principper molekylær dynamik simuleringer. Billede af Viktor Rozsa/University of Chi -
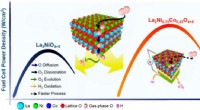 Nyopdagede designregler fører til bedre brændselscellekatalysatorForskere afslørede hemmeligheden bag at designe elektroder med bedre ydeevne (elektrokatalysatorer). Effektdensitetskurverne viser, at den nydesignede katalysator (rød kurve) overgår en lignende katal
Nyopdagede designregler fører til bedre brændselscellekatalysatorForskere afslørede hemmeligheden bag at designe elektroder med bedre ydeevne (elektrokatalysatorer). Effektdensitetskurverne viser, at den nydesignede katalysator (rød kurve) overgår en lignende katal


