Hvorfor fryser saltvand under 0 celsius?
* frysningspunktdepression: Når du opløser salt (NaCl) i vand, forstyrrer saltioner (Na+ og Cl-) dannelsen af den almindelige, krystallinske struktur, som rent vand dannes, når det fryser. Vandmolekylerne skal være længere fra hinanden for at rumme saltioner, hvilket kræver en lavere temperatur for at størkne.
* Kolligativ egenskab: Frysepunktdepression er en colligativ egenskab, hvilket betyder, at det afhænger af antallet af opløste partikler i en opløsning, ikke den specifikke type opløst stof. Så ethvert opløst stof vil til en vis grad sænke vandets frysepunkt.
* saltholdighed: Jo mere salt opløses i vandet, jo lavere er frysepunktet. Havvand med en gennemsnitlig saltholdighed på ca. 3,5%fryser på ca. -1,9 grader Celsius (-2,8 grader Fahrenheit).
Kortfattet: Tilstedeværelsen af saltioner i vand forstyrrer dannelsen af iskrystaller, hvilket kræver en lavere temperatur til løsningen til størkning.
Sidste artikelHvad danner rammen for alle organiske molekyler?
Næste artikelHvorfor har Octane et højere kogepunkt og derefter vand?
 Varme artikler
Varme artikler
-
 Kemikere skaber ny krystalform for insekticid, øger dets evne til at bekæmpe myg og malariaNew York University-forskere har skabt en ny krystalform af deltamethrin - et almindeligt insekticid, der bruges til at kontrollere malaria - hvilket resulterer i et insekticid, der er op til 12 gange
Kemikere skaber ny krystalform for insekticid, øger dets evne til at bekæmpe myg og malariaNew York University-forskere har skabt en ny krystalform af deltamethrin - et almindeligt insekticid, der bruges til at kontrollere malaria - hvilket resulterer i et insekticid, der er op til 12 gange -
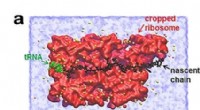 Mekanisk kraft styrer proteinsyntesens hastighedForskere opdagede, at proteiner, repræsenteret ved den sorte linje, udøver en mekanisk kraft, når de forlader den molekylære maskine, hvor de syntetiseres, repræsenteret med rødt. Denne kraft moderere
Mekanisk kraft styrer proteinsyntesens hastighedForskere opdagede, at proteiner, repræsenteret ved den sorte linje, udøver en mekanisk kraft, når de forlader den molekylære maskine, hvor de syntetiseres, repræsenteret med rødt. Denne kraft moderere -
 Undersøgelse peger på en proces, der kunne have ført til de første organiske molekylerKredit:CC0 Public Domain Ny forskning ledet af American Museum of Natural History og finansieret af NASA identificerer en proces, der kunne have været nøglen til at producere de første organiske m
Undersøgelse peger på en proces, der kunne have ført til de første organiske molekylerKredit:CC0 Public Domain Ny forskning ledet af American Museum of Natural History og finansieret af NASA identificerer en proces, der kunne have været nøglen til at producere de første organiske m -
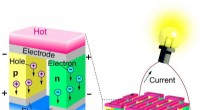 Flere halvleder type switch til at øge termoelektrisk konvertering af spildvarmeTinmonoselenid (SnSe), når dopet med antimon (Sb), kan danne en egnet kandidat til design af termoelektriske konverteringselementer (p-n-forbindelsesenhed). Kredit:Tokyo Tech I de seneste år, ener
Flere halvleder type switch til at øge termoelektrisk konvertering af spildvarmeTinmonoselenid (SnSe), når dopet med antimon (Sb), kan danne en egnet kandidat til design af termoelektriske konverteringselementer (p-n-forbindelsesenhed). Kredit:Tokyo Tech I de seneste år, ener
- Zuckerberg for at forklare, hvordan Facebook fokuserer på privatlivets fred
- Hvilke to ting deler etniske grupper?
- Hvilken væske bliver til et fast stof, når det koger?
- Hvilke typer bindinger danner aktinider?
- Finder du stabler buer og huler i Flamborough Head?
- Mysteriet om universets ekspansionshastighed udvides med nye Hubble-data


