Hvor mange atomer af aluminium er der i en prøvesulfid med masse 100 g?
1. Bestem den kemiske formel
Aluminiumsulfid er sammensat af aluminium (AL) og svovl (er). Den kemiske formel for aluminiumssulfid er al₂s₃.
2. Beregn den molære masse
* Den molære masse af aluminium (AL) er 26,98 g/mol.
* Den molære masse af svovl (er) er 32,07 g/mol.
Den molære masse af al₂s₃ er:(2 * 26,98 g/mol) + (3 * 32,07 g/mol) =150,17 g/mol
3. Beregn antallet af mol
* Vi har en 100 g prøve af Al₂s₃.
* Opdel prøvemassen med den molære masse for at få antallet af mol:100 g / 150,17 g / mol =0,666 mol Al₂s₃.
4. Beregn antallet af aluminiumatomer
* Hver mol Al₂s₃ indeholder 2 mol aluminiumatomer.
* Multiplicer antallet af mol Al₂s₃ med 2 for at få antallet af mol aluminium:0,666 mol * 2 =1,332 mol aluminium.
* Brug Avogadros nummer (6,022 x 10²³ atomer/mol) til at konvertere mol aluminium til antallet af atomer:1,332 mol * 6,022 x 10²³ atomer/mol = 8,02 x 10²³ atomer af aluminium.
Derfor er der ca. 8,02 x 10²³ aluminiumatomer i en 100 g prøve af aluminiumsulfid.
Sidste artikelHvor mange hydrogenatomer er i 3,40 mol ammoniumsulfid?
Næste artikelHydrogensulfid har hvor mange atomer?
 Varme artikler
Varme artikler
-
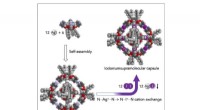 En ny hexamerisk molekylær kapsel i nanostørrelseEthylenbro-tetrakis (4-pyridyl) kavit og samler sig selv i en 4 nm oktaedrisk hexamer kapsel, når den behandles med sølvtosylat i chloroform. Kredit:Jyväskylä Universitet Haloniumioner brugt i den
En ny hexamerisk molekylær kapsel i nanostørrelseEthylenbro-tetrakis (4-pyridyl) kavit og samler sig selv i en 4 nm oktaedrisk hexamer kapsel, når den behandles med sølvtosylat i chloroform. Kredit:Jyväskylä Universitet Haloniumioner brugt i den -
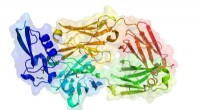 Løsning af livets mysterier:Krystallografer identificerer 1, 000 proteinstrukturerPDB ID:6B0S Den canadiske lyskilde fejrer to milepæle nået af videnskabsmænd, der har udført forskning på den nationale facilitet ved University of Saskatchewan. Forskere har løst 1, 000 proteins
Løsning af livets mysterier:Krystallografer identificerer 1, 000 proteinstrukturerPDB ID:6B0S Den canadiske lyskilde fejrer to milepæle nået af videnskabsmænd, der har udført forskning på den nationale facilitet ved University of Saskatchewan. Forskere har løst 1, 000 proteins -
 Knækker koden til soddannelse - forskere låser op for mysterium for at hjælpe med at reducere far…Forskere har opdaget en mekanisme til soddannelse, løse et mangeårigt videnskabeligt mysterium. På dette billede af en stearinlysflamme, farverne er fra varm sodluminescens. Massespektret i bunden vis
Knækker koden til soddannelse - forskere låser op for mysterium for at hjælpe med at reducere far…Forskere har opdaget en mekanisme til soddannelse, løse et mangeårigt videnskabeligt mysterium. På dette billede af en stearinlysflamme, farverne er fra varm sodluminescens. Massespektret i bunden vis -
 Rystet og omrørt:Forskere fanger deformationseffekten af chokbølger på et materialeAluminiumsfolie bestrålet af en laserdrevet chokbølge efterfølges af en røntgenimpuls for at aflæse diffraktionsmønsteret af krystalstrukturen. Kredit:Tokyo Tech At forstå, hvordan chokbølger påvi
Rystet og omrørt:Forskere fanger deformationseffekten af chokbølger på et materialeAluminiumsfolie bestrålet af en laserdrevet chokbølge efterfølges af en røntgenimpuls for at aflæse diffraktionsmønsteret af krystalstrukturen. Kredit:Tokyo Tech At forstå, hvordan chokbølger påvi
- Pink + pink =guld? Hybrid kolibriens fjer matcher ikke dens forældres
- Togstationseksperiment afslører en måde at modvirke skævhed mod muslimer
- Hvilke planter kan lære os om rensning af olieudslip og mikrofluidik
- Hvilken type stødende klippe dannes ved divergerende grænser?
- Hvad betyder reglerne om beskyttelse af bredbåndsbeskyttelse
- Team demonstrerer den første store grafenfremstilling


