Hvilken egenskab ved calciumoxid forklarer gitterstrukturen?
Her er hvorfor:
* ionisk binding: CAO har en krystalgitterstruktur, der holdes sammen af stærke elektrostatiske kræfter mellem de positivt ladede calciumioner (Ca²⁺) og de negativt ladede oteioner (O²⁻). Disse ioniske bindinger er meget stærke.
* Stærke attraktioner: For at smelte eller koge CAO skal du overvinde disse stærke ioniske attraktioner. Dette kræver en betydelig mængde energi, og dermed de høje smelte- og kogepunkter.
Fortæl mig, hvis du gerne vil vide mere om CAO's gitterstruktur!
Sidste artikelAntallet af gram i 2,65 mol SO2 er 2,65?
Næste artikelHvilken gas produceres, når MG (er) tilføjes til HCL (aq)?
 Varme artikler
Varme artikler
-
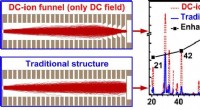 Forbedring af iontransmissionseffektiviteten af massespektrometreFokuseringseffekt af DC-ion-tragten. Kredit:Zhang Qiangling En nylig undersøgelse foretaget af forskere fra Hefei Institutes of Physical Science og offentliggjort i Analytical Chemistry præsenterer
Forbedring af iontransmissionseffektiviteten af massespektrometreFokuseringseffekt af DC-ion-tragten. Kredit:Zhang Qiangling En nylig undersøgelse foretaget af forskere fra Hefei Institutes of Physical Science og offentliggjort i Analytical Chemistry præsenterer -
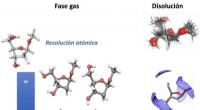 DNA -sukker karakteriseret i en hidtil uset opløsning, atom for atomTil venstre, strukturerne er fuldstændigt isoleret fra ethvert eksternt middel (opløsningsmiddel, krystallinsk bundtning) og til højre, strukturerne i vandet. I den mest rigelige struktur, de faste pr
DNA -sukker karakteriseret i en hidtil uset opløsning, atom for atomTil venstre, strukturerne er fuldstændigt isoleret fra ethvert eksternt middel (opløsningsmiddel, krystallinsk bundtning) og til højre, strukturerne i vandet. I den mest rigelige struktur, de faste pr -
 Ildfluer kaster lys over mitokondriernes funktionKredit:CC0 Public Domain Små fabrikker flyder inde i vores celler og giver dem næsten al den energi, de har brug for:mitokondrierne. Deres effektivitet falder, når vi bliver ældre, men også når vi
Ildfluer kaster lys over mitokondriernes funktionKredit:CC0 Public Domain Små fabrikker flyder inde i vores celler og giver dem næsten al den energi, de har brug for:mitokondrierne. Deres effektivitet falder, når vi bliver ældre, men også når vi -
 Ny metode mere end fordobler sukkerproduktionen fra planterBøgetræ under dekonstruktion. Kredit:Ydna Questell-Santiago (EPFL Laboratory of Sustainable and Catalytic Processing) Fremstilling af brændstoffer og kemikalier fra biomasse (træ, græsser, osv.) e
Ny metode mere end fordobler sukkerproduktionen fra planterBøgetræ under dekonstruktion. Kredit:Ydna Questell-Santiago (EPFL Laboratory of Sustainable and Catalytic Processing) Fremstilling af brændstoffer og kemikalier fra biomasse (træ, græsser, osv.) e
- Hvorfor Great Plains har så episk vejr
- Sådan skitser du grafen for firkantede rotfunktioner, (f (x) = √ x)
- Er testaen i planter frøfrakke?
- Brydning med tyre, diæter til kun kød og sexforbud:Sådan forberedte de gamle olympiere
- Forskeren forbinder laksekøn med geologiske ændringer
- Facebook stort projekt om journalistik sat i denne uge


