Hvilken løsning er mest sandsynligt at producere krystaller, hvis de forstyrres?
Her er hvorfor og hvad vi skal overveje:
* opløsningssammensætning: Typen af opløst stof (stoffet opløses) og opløsningsmidlet (stoffet, der gør opløsningen) er afgørende. For eksempel er det mere sandsynligt, at opløsninger af salte som sukker eller bordsalt krystalliseres end opløsninger af organiske molekyler som alkohol eller eddike.
* Koncentration: En overmættet opløsning (med mere opløst stof, end den normalt kunne ved en given temperatur) er meget mere tilbøjelig til at krystallisere end en fortyndet opløsning.
* Temperatur: Afkøling af en løsning kan ofte få den til at blive overmættet og øge sandsynligheden for krystallisation.
* nucleation -steder: Forstyrrelser introducerer ufuldkommenheder eller "frø", der kan fungere som nucleationssteder, hvor krystaller begynder at dannes.
Eksempler:
* overmættet sukkeropløsning: Hvis du ryster en overmættet sukkeropløsning, vil du sandsynligvis se, at krystaller hurtigt dannes.
* Rock Candy: En overmættet sukkeropløsning forstyrres bevidst ved at tilføje en streng eller holde sig til at fremme krystalvækst.
* saltopløsning: En mættet saltopløsning kan muligvis krystallisere langsomt over tid, men foruroligende kan det tilskynde til hurtigere krystallisation.
For at få et bedre svar skal du give flere detaljer om den løsning, du er interesseret i!
 Varme artikler
Varme artikler
-
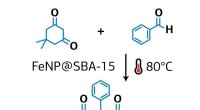 Kemiker foreslår en ny metode til grøn syntese af xanthenderivaterKredit:RUDN University En RUDN -kemiker har foreslået en ny metode til syntese af xanthenderivater, som bruges som grundlag for fremstilling af lægemidler - fra antidepressiva til antivirale og an
Kemiker foreslår en ny metode til grøn syntese af xanthenderivaterKredit:RUDN University En RUDN -kemiker har foreslået en ny metode til syntese af xanthenderivater, som bruges som grundlag for fremstilling af lægemidler - fra antidepressiva til antivirale og an -
 Forskere udvikler ny behandling for knogleinfektion ved hjælp af kobberrigt glasimplantatUndersøgelsens første forfatter Emily Ryan, en nyligt kvalificeret ph.d.-studerende i RCSI Institut for Anatomi, afbilledet med prof Fergal OBrien, Professor i bioingeniør og regenerativ medicin i RCS
Forskere udvikler ny behandling for knogleinfektion ved hjælp af kobberrigt glasimplantatUndersøgelsens første forfatter Emily Ryan, en nyligt kvalificeret ph.d.-studerende i RCSI Institut for Anatomi, afbilledet med prof Fergal OBrien, Professor i bioingeniør og regenerativ medicin i RCS -
 Kemikere hæmmer et kritisk gear til celleudødelighedTelomerase-ekspression bidrager til Kræftens kendetegn hovedsageligt gennem sin kanoniske rolle i telomervedligeholdelse og replikativ dødelighed. Telomerase (vist i gråt) kan hæmmes med en ny klasse
Kemikere hæmmer et kritisk gear til celleudødelighedTelomerase-ekspression bidrager til Kræftens kendetegn hovedsageligt gennem sin kanoniske rolle i telomervedligeholdelse og replikativ dødelighed. Telomerase (vist i gråt) kan hæmmes med en ny klasse -
 Syre kan være nøgleingrediens for bedre klæbestyrke, elektroniske komponenterKredit:CC0 Public Domain En syre, der bruges til medicin og til at smage nogle drikkevarer snart, kan hjælpe med at gøre elektroniske komponenter og visse klæbemidler mere holdbare og bedre for mi
Syre kan være nøgleingrediens for bedre klæbestyrke, elektroniske komponenterKredit:CC0 Public Domain En syre, der bruges til medicin og til at smage nogle drikkevarer snart, kan hjælpe med at gøre elektroniske komponenter og visse klæbemidler mere holdbare og bedre for mi


