Hvilke slags elementer er forbundet med kovalent binding?
* Elektronegativitet: Ikke -metaller har en højere elektronegativitet end metaller. Dette betyder, at de har en stærkere attraktion for elektroner.
* Deling af elektroner: I en kovalent binding deler atomer elektroner for at opnå en stabil elektronkonfiguration (normalt en fuld ydre skal). Da ikke -metaller er tæt på at have en fuld ydre skal, deler de let elektroner.
* Typer af kovalente obligationer:
* rene kovalente obligationer: Disse forekommer mellem atomer af det samme element (f.eks. O2, H2, Cl2).
* polære kovalente obligationer: Disse forekommer mellem atomer af forskellige elementer, hvor elektronerne deles ulige (f.eks. H2O, CO2).
Eksempler på kovalent binding:
* H2O (vand): Hydrogen (ikke -metal) og ilt (ikke -metal) deler elektroner.
* CO2 (kuldioxid): Carbon (ikke -metal) og ilt (ikke -metal) deler elektroner.
* NH3 (ammoniak): Nitrogen (ikke -metal) og brint (ikke -metal) deler elektroner.
* CH4 (metan): Carbon (ikke -metal) og brint (ikke -metal) deler elektroner.
Undtagelser:
Mens de fleste kovalente obligationer involverer ikke -metaller, er der nogle få undtagelser:
* Metalliske obligationer: Disse involverer deling af elektroner mellem metalatomer.
* nogle metal-ikke-metale obligationer: I nogle tilfælde kan et metal og en ikke -metal danne en kovalent binding, såsom i aluminiumchlorid (ALCL3).
Key Takeaway: Kovalent binding er en kraftig kraft, der holder atomer sammen i molekyler og er mest almindelig mellem ikke -metaller på grund af deres fælles tendens til at vinde elektroner.
Sidste artikelHvorfor brænder syre gennem genstande?
Næste artikelHvad er navnet, der gives til reaktioner, der tager varme?
 Varme artikler
Varme artikler
-
 Ny metode giver forskere mulighed for hurtigt at se individuelle viruspartiklerEt sammensat billede af herpes simplex virus partikler, opnået af AFM-IR. (Billede udlånt af Dmitry Kurouski) Influenza, SARS-CoV-2 og andre vira kommer i en lang række forskellige former og størr
Ny metode giver forskere mulighed for hurtigt at se individuelle viruspartiklerEt sammensat billede af herpes simplex virus partikler, opnået af AFM-IR. (Billede udlånt af Dmitry Kurouski) Influenza, SARS-CoV-2 og andre vira kommer i en lang række forskellige former og størr -
 Optiske overtoner til solcellerAnalogt med et fænomen kendt for musikinstrumenter, når overtoner af to forskellige grundtoner kommer i resonans, forskere fra LMU München har fundet en ny effekt med hensyn til optisk excitation af l
Optiske overtoner til solcellerAnalogt med et fænomen kendt for musikinstrumenter, når overtoner af to forskellige grundtoner kommer i resonans, forskere fra LMU München har fundet en ny effekt med hensyn til optisk excitation af l -
 Overflademodifikation for at forbedre in vivo-levetiden for bioimplantaterKredit:Frontiers of Mechanical Engineering . DOI:10.1007/s11465-022-0682-6 For nylig har forskere fra University College Dublin lavet nogle nye udviklinger for at øge in vivo-levetiden for kunstige
Overflademodifikation for at forbedre in vivo-levetiden for bioimplantaterKredit:Frontiers of Mechanical Engineering . DOI:10.1007/s11465-022-0682-6 For nylig har forskere fra University College Dublin lavet nogle nye udviklinger for at øge in vivo-levetiden for kunstige -
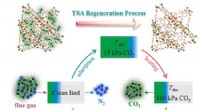 Strategi til evaluering af energiydeevnen af metal-organiske-ramme-baserede kuldioxidadsorbenterSkematisk diagram af CO2-adsorbentsløjfe i en TSA-cyklus efter forbrænding. Kredit:Luo Jipeng Som lovende kuldioxid (CO2 ) adsorbenter, metal-organiske rammer (MOFer) har tiltrukket sig stor opmærk
Strategi til evaluering af energiydeevnen af metal-organiske-ramme-baserede kuldioxidadsorbenterSkematisk diagram af CO2-adsorbentsløjfe i en TSA-cyklus efter forbrænding. Kredit:Luo Jipeng Som lovende kuldioxid (CO2 ) adsorbenter, metal-organiske rammer (MOFer) har tiltrukket sig stor opmærk
- Off-cycle valg resulterer i mindre repræsentative lokale regeringer
- Magnetisk perlemanipulation i mikrofluidchips til biologisk anvendelse
- Google tilbyder løsninger for at undgå flere EU -Android -bøder
- Forskere vender en magnetisk hukommelsescelle med en lyspuls ved rekordhastighed
- Ingeniører bygger verdens mindste, hurtigste nanomotor
- Brug af forskning til at afslutte moderne slaveri


