Hvorfor bruges ammoniumnitrat i Salt Bridge?
Her er hvorfor:
* opløselighed: KCL er meget opløselig i vand, hvilket sikrer god ledningsevne i saltbroen.
* ionmobilitet: Kalium- og chloridioner har lignende mobiliteter i opløsning, hvilket betyder, at de bevæger sig med omtrent samme hastighed, hvilket forhindrer den ene ion i at akkumulere hurtigere end den anden og skabe en ujævn ladningsfordeling.
* reaktivitet: KCL er relativt inert og usandsynligt at reagere med opløsningerne i de elektrokemiske celler, hvilket sikrer, at saltbroen ikke indfører yderligere kemiske reaktioner.
Mens ammoniumnitrat er et salt, bruges det ikke almindeligt i saltbroer af nogle få grunde:
* ionmobilitet: Ammoniumionen (NH₄⁺) er generelt mere mobil end nitrationen (NO₃⁻). Denne forskel i mobilitet kan føre til en ujævn ladningsfordeling inden for saltbroen, hvilket påvirker systemets elektriske neutralitet.
* Potentiale for reaktioner: Ammoniumnitrat kan være tilbøjelig til reaktioner med visse opløsninger, især dem, der indeholder stærke baser. Dette kan påvirke den samlede elektrokemiske proces.
Kortfattet: KCL er det foretrukne salt til saltbroer på grund af dets høje opløselighed, lignende ionmobilitet og inert natur. Mens ammoniumnitrat er et salt, gør dets egenskaber det mindre egnet til denne anvendelse.
Sidste artikelHvordan ser Europium ud?
Næste artikelVed hvilken kerlvin temperatur vil 300 g sukker opløses i vand?
 Varme artikler
Varme artikler
-
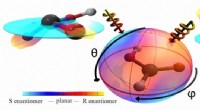 Duplikat eller spejl? Laserlys bestemmer chiralitet af molekylerMyresyremodellen er i centrum. Farvekoden for den omgivende kugle viser myresyrens direkte chiralitet for hver retning, hvorfra laseren kommer. Kredit:Goethe-Universität Frankfurt am Main I medici
Duplikat eller spejl? Laserlys bestemmer chiralitet af molekylerMyresyremodellen er i centrum. Farvekoden for den omgivende kugle viser myresyrens direkte chiralitet for hver retning, hvorfra laseren kommer. Kredit:Goethe-Universität Frankfurt am Main I medici -
 Forskeren skaber 3D-trykt multimateriale med programmeret stivhedEn mikro-gitterstruktur lavet af forskellige materialer. Programmerbar additiv fremstilling i flere materialer tillader udskrivning af materialer med forskellig modul uden krydskontaminering. Kredit:V
Forskeren skaber 3D-trykt multimateriale med programmeret stivhedEn mikro-gitterstruktur lavet af forskellige materialer. Programmerbar additiv fremstilling i flere materialer tillader udskrivning af materialer med forskellig modul uden krydskontaminering. Kredit:V -
 Lyser vejen til porøs elektronik og sensorerFig.1 Nanostruktur porøs titaniumoxid tynd film (TiOx) aflejret på plast (PI:polyimid) substratet. Kredit:Osaka University Mange almindelige husholdningsartikler og enheder har en belægning, der f
Lyser vejen til porøs elektronik og sensorerFig.1 Nanostruktur porøs titaniumoxid tynd film (TiOx) aflejret på plast (PI:polyimid) substratet. Kredit:Osaka University Mange almindelige husholdningsartikler og enheder har en belægning, der f -
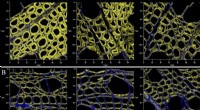 Kvantificering af ændringer i overfladekemi af træplanter under mikrobiel gæringORNL -forskere brugte sofistikerede laserscanningsteknikker til at sammenligne nedbrydningen af fermenteret populær (B) sammenlignet med ugæret populær (A), som de kvantificerede, for første gang, k
Kvantificering af ændringer i overfladekemi af træplanter under mikrobiel gæringORNL -forskere brugte sofistikerede laserscanningsteknikker til at sammenligne nedbrydningen af fermenteret populær (B) sammenlignet med ugæret populær (A), som de kvantificerede, for første gang, k
- Er jorden en stor klippe?
- Små hvalarter
- Klimaændringer og snesmeltning - skru op for varmen, men hvad med luftfugtighed?
- Overflader med kontrolleret befugtning til at fange og identificere molekyler ved sporkoncentratione…
- Hvad er ordligningen for rubidium og klor?
- Hvad er begivenheden, der finder sted, når energi fra solen rejser gennem en pyramide?


