Hvordan adlyder ilt -octect -reglen, når man reagerer på at danne forbindelser?
efter octetreglen:
* Oxygen's elektroniske konfiguration: Oxygen har seks elektroner i sin yderste skal (2S² 2P⁴). For at opnå en stabil octet skal den få yderligere to elektroner.
* Dannelse af forbindelser: Oxygen opnår en stabil oktet ved at danne kovalente bindinger med andre atomer og dele elektroner. For eksempel:
* vand (H₂O): Oxygen deler to elektroner med to hydrogenatomer, der danner to kovalente bindinger. Dette giver ilt i alt otte elektroner i sin valensskal.
* kuldioxid (co₂): Oxygen deler to elektroner med hvert carbonatom og danner to dobbeltbindinger. Dette resulterer igen i otte elektroner omkring ilt.
Undtagelser fra Octet -reglen:
* hypervalente forbindelser: I nogle forbindelser kan ilt have mere end otte elektroner i sin valensskal. Dette forekommer i forbindelser som oxoniumion (H₃O⁺) , hvor ilt danner tre kovalente bindinger og har et ensomt par. Det har i alt ti elektroner i sin valensskal.
* frie radikaler: Oxygen kan eksistere som en fri radikal, såsom superoxidradikal (O₂⁻) . I dette tilfælde har ilt syv elektroner i sin valensskal.
nøglepunkter at huske:
* octet -regel er en retningslinje: Det er et nyttigt princip for at forstå binding, men det er ikke en absolut regel.
* Undtagelser findes: Der er mange undtagelser fra Octet -reglen, især med elementer i den anden periode og fremover.
* Forståelse af binding: Selv med undtagelser hjælper Octet -reglen os med at forstå drivkraften bag kemisk binding og stabiliteten af forbindelser.
Fortæl mig, hvis du har andre spørgsmål om ilt eller oktetreglen!
Sidste artikelNår der tilsættes rød litmus til eddikesyre, hvad vil farven på papir?
Næste artikelHvordan leveres ilt til kroppen?
 Varme artikler
Varme artikler
-
 Polymerer springer gennem bøjler på vej til bæredygtige materialerKemisk og biomolekylær ingeniørprofessor Charles Schroeder, venstre, og kandidatstuderende Yuecheng (Peter) Zhou studerer flowdynamikken i ring- og lineære polymerløsninger for at aflæse spor om, hvor
Polymerer springer gennem bøjler på vej til bæredygtige materialerKemisk og biomolekylær ingeniørprofessor Charles Schroeder, venstre, og kandidatstuderende Yuecheng (Peter) Zhou studerer flowdynamikken i ring- og lineære polymerløsninger for at aflæse spor om, hvor -
 Ny forskning giver bedre forståelse af hudens holdbarhedKredit:Unsplash/CC0 Public Domain Som en, der grundigt har studeret, hvad naturen har frembragt, kan lektor Guy German godt lide at fortælle sine elever:Du tror, du er en god ingeniør, men evolut
Ny forskning giver bedre forståelse af hudens holdbarhedKredit:Unsplash/CC0 Public Domain Som en, der grundigt har studeret, hvad naturen har frembragt, kan lektor Guy German godt lide at fortælle sine elever:Du tror, du er en god ingeniør, men evolut -
 Molekylær skala på biologiske membranerKredit:CNX OpenStax, CC BY 4.0 Cellulære processer på membraner er ofte hurtige og kortvarige. Molekyler samles kort, adskilles igen, interagerer med forskellige partnere og bevæger sig langs elle
Molekylær skala på biologiske membranerKredit:CNX OpenStax, CC BY 4.0 Cellulære processer på membraner er ofte hurtige og kortvarige. Molekyler samles kort, adskilles igen, interagerer med forskellige partnere og bevæger sig langs elle -
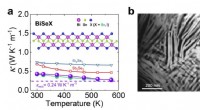 Ekstremt lav varmeledningsevne i 1-D blød kædestruktur(a) Den termiske ledningsevne som funktion af temperaturen. Insert er kædestrukturen af BiSeI. (b) Morfologien af trådformede kæder i 1D BiSeI. Kredit:©Science China Press Forskere har rapport
Ekstremt lav varmeledningsevne i 1-D blød kædestruktur(a) Den termiske ledningsevne som funktion af temperaturen. Insert er kædestrukturen af BiSeI. (b) Morfologien af trådformede kæder i 1D BiSeI. Kredit:©Science China Press Forskere har rapport
- Hvem kører i passagertog i USA i disse dage?
- Hvordan Facebook springer ned på falske nyheder (og hvorfor falske nyheder fungerer)
- Gravehvepse og deres kemi
- Hollænderne slutter sig til G7-ledet fremstød for at befri oceaner af plastik
- Signaturtilgang afslører værdsatte egenskaber i nanoskopisk materiale
- Hvordan klimaændringer vil påvirke Māori, og hvordan man tilpasser sig


