De tre hovedtyper af kemiske bindinger er?
1. ioniske bindinger: Disse obligationer dannes, når et atom donerer Et elektron til et andet atom, der skaber modsat ladede ioner, der tiltrækkes af hinanden. Dette forekommer typisk mellem metaller og ikke -metaller. For eksempel holdes natriumchlorid (NaCI) sammen af en ionisk binding.
2. kovalente obligationer: Disse obligationer dannes, når to atomer deler Elektroner. Denne type obligation opstår mellem ikke -metaller. For eksempel holdes vandmolekylet (H2O) sammen af kovalente bindinger.
3. Metalliske obligationer: Disse bindinger dannes mellem metalatomer. I en metallisk binding er elektroner delokaliserede og kan bevæge sig frit gennem metalgitteret og skabe et "hav af elektroner." Dette forklarer, hvorfor metaller er gode ledere af varme og elektricitet.
Selvom dette er de tre hovedtyper, er det værd at bemærke, at der også er andre, mindre almindelige typer bindinger, såsom brintbindinger og van der Waals -styrker. Disse betragtes som svagere end de vigtigste tre typer, men spiller vigtige roller i biologiske systemer og andre aspekter af kemi.
 Varme artikler
Varme artikler
-
 En ny type kemisk binding:Charge-shift-bindingenEt univers af kemiske ligninger. Kredit:Nikolayenko Yekaterina/Shutterstock.com John Morrison Galbraith er lektor i kemi ved Marist College, der studerer kemisk binding, som er den proces, der hol
En ny type kemisk binding:Charge-shift-bindingenEt univers af kemiske ligninger. Kredit:Nikolayenko Yekaterina/Shutterstock.com John Morrison Galbraith er lektor i kemi ved Marist College, der studerer kemisk binding, som er den proces, der hol -
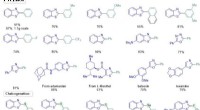 Krydskoblingsreaktioner:Semiheterogen PCN-Cu baseret metallafotokatalyseDobbelt Cu/halvleder fotokatalyseret C-H arylering, chalcogenering og C – N krydskoblingsreaktioner. Kredit:Science China Press For nylig, photoredox-katalyse har vist sig som en tiltalende koblin
Krydskoblingsreaktioner:Semiheterogen PCN-Cu baseret metallafotokatalyseDobbelt Cu/halvleder fotokatalyseret C-H arylering, chalcogenering og C – N krydskoblingsreaktioner. Kredit:Science China Press For nylig, photoredox-katalyse har vist sig som en tiltalende koblin -
 Optrævling af den molekylære kompleksitet af cellulære maskiner og miljøprocesser21-Tesla Fourier transformation ion cyclotron resonans massespektrometer (data vist til højre) vil drive den fremtidige retning af miljø, biologiske, atmosfærisk, og energiforskning. Kredit:Pacific No
Optrævling af den molekylære kompleksitet af cellulære maskiner og miljøprocesser21-Tesla Fourier transformation ion cyclotron resonans massespektrometer (data vist til højre) vil drive den fremtidige retning af miljø, biologiske, atmosfærisk, og energiforskning. Kredit:Pacific No -
 Forskere muliggør indenlandske højtydende bipolære membranerKredit:University of Science and Technology of China Den bipolare membran, en type ionbytningsmembran, betragtes som det afgørende materiale for nulemissionsteknologi. Det består af et anode- og k
Forskere muliggør indenlandske højtydende bipolære membranerKredit:University of Science and Technology of China Den bipolare membran, en type ionbytningsmembran, betragtes som det afgørende materiale for nulemissionsteknologi. Det består af et anode- og k
- Sølv -nanostrukturer udviser resonansfunktion, der er nyttig til en lang række sanseapplikationer
- Grønlandshvaler kommer til Cumberland Sound i Nunavut for at eksfoliere
- Hvad er mængden af bordsukker, der opløses i 1 kg vand, kan øges med?
- Klimakatastrofen er sket før - og den lærer os om fremtiden
- Video:Bringer forbindelse til månen
- Hvad brækker man en dobbelt helix af DNA?


