For at bestemme, hvilke af produkterne og nedbørreaktionen der er bundfald, skal du følge?
1. Identificer reaktanterne og deres ioniske former:
* Skriv de kemiske formler for reaktanterne.
* Opdel hver reaktant i dens bestanddel ioner i betragtning af deres afgifter. For eksempel bryder NaCl ned i Na⁺ og Cl⁻ioner.
2. Forudsig de mulige produkter:
* Byt kationerne og anionerne af reaktanterne. Dette er baseret på ideen om, at de positive ioner (kationer) switchpartnere (kationer) switchpartnere.
3. Bestem opløseligheden af de potentielle produkter:
* Konsulter en opløselighedstabel: Disse borde indikerer, om en forbindelse er opløselig, let opløselig eller uopløselig i vand.
* Generelle opløselighedsregler: Du kan også bruge generelle opløselighedsregler som en retningslinje:
* de fleste alkalimetalsalte (Li⁺, Na⁺, K⁺, RB⁺, CS⁺) er opløselige.
* de fleste nitrat (no₃⁻) salte er opløselige.
* de fleste chlorid (cl⁻), bromid (br⁻) og iodid (i⁻) salte er opløselige, bortset fra dem med ag⁺, pb²⁺ og hg₂²⁺.
* mest sulfat (so²⁻) salte er opløselige, bortset fra dem med ba²⁺, sr²⁺, Ca²⁺, pb²⁺ og hg₂²⁺.
* de fleste carbonat (co₃²⁻) og phosphat (po₄³⁻) salte er uopløselige, bortset fra dem med alkalimetaller og ammonium (NH₄⁺).
* de fleste hydroxid (OH⁻) salte er uopløselige, bortset fra dem med alkalimetaller og Ca²⁺, SR²⁺ og Ba²⁺.
4. Identificer bundfaldet:
* Produktet, der er uopløseligt I vand er bundfaldet. Det vil danne et fast stof, der sætter sig ud af opløsningen.
Eksempel:
Lad os sige, at du reagerer vandige opløsninger af sølvnitrat (Agno₃) og natriumchlorid (NaCl).
1. reaktanter og ioner:
* Agno₃ → Ag⁺ + no₃⁻
* NaCl → Na⁺ + Cl⁻
2. mulige produkter:
* AG⁺ + CL⁻ → AGCL (sølvchlorid)
* Na⁺ + No₃⁻ → Nano₃ (natriumnitrat)
3. opløselighed:
* AGCL er uopløselig i vand (i henhold til opløselighedsreglerne).
* Nano₃ er opløselig i vand.
4. bundfald:
* agcl er bundfaldet.
I reaktionen mellem sølvnitrat og natriumchlorid er bundfaldet dannet sølvchlorid (AgCl).
Sidste artikelHvor mange mol aluminiumoxid er i 12,75 g aluminiumoxidened at vide?
Næste artikelHvor mange atomer er der i H2SO4?
 Varme artikler
Varme artikler
-
 Kemikere udvikler nyt reagens til de-elektroneringPerhaloanthracen-radikalkationer delelektroniserer trimetaldodecacarbonyler under carbonmonoxidtryk for at danne de første klyngede overgangsmetalkationer. Kredit:Leveret af forskningsgruppen Kemik
Kemikere udvikler nyt reagens til de-elektroneringPerhaloanthracen-radikalkationer delelektroniserer trimetaldodecacarbonyler under carbonmonoxidtryk for at danne de første klyngede overgangsmetalkationer. Kredit:Leveret af forskningsgruppen Kemik -
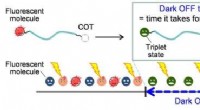 Når FRETING over cancerbiomarkører ikke virker, fokusere på at blinke i stedet forSkematisk repræsentation af fluorescensblink styret af tripletdannelse og triplet-triplet energioverførsel. Kredit:Osaka University Fluorescensspektroskopi er uundværlig i biomedicinsk diagnostik.
Når FRETING over cancerbiomarkører ikke virker, fokusere på at blinke i stedet forSkematisk repræsentation af fluorescensblink styret af tripletdannelse og triplet-triplet energioverførsel. Kredit:Osaka University Fluorescensspektroskopi er uundværlig i biomedicinsk diagnostik. -
 Forskning viser fingeraftryk på vejKredit:University of Abertay Dundee Ny forskning ved Abertay University har opdaget, at gerningsstedets fingeraftryk kan flytte sig, efter at de er blevet deponeret. Projektet ledet af Abertays r
Forskning viser fingeraftryk på vejKredit:University of Abertay Dundee Ny forskning ved Abertay University har opdaget, at gerningsstedets fingeraftryk kan flytte sig, efter at de er blevet deponeret. Projektet ledet af Abertays r -
 Forskere beskriver strukturen af et potentielt luminescerende stofStrukturen af det nye stof. Kredit:Maksim Molokeev. En fysiker fra Siberian Federal University (SFU) og Kirensky Institute of Physics Federal Research Center KSC SB RAS (IF) har beskrevet strukt
Forskere beskriver strukturen af et potentielt luminescerende stofStrukturen af det nye stof. Kredit:Maksim Molokeev. En fysiker fra Siberian Federal University (SFU) og Kirensky Institute of Physics Federal Research Center KSC SB RAS (IF) har beskrevet strukt
- Hvor mange jordbunter lavede John Glenn?
- Hvad betyder reference på en videnskabsmesse?
- Enkel metode til keramisk-baserede fleksible elektrolytplader til lithiummetalbatterier
- Hvorfor kan en forhøjelse af alkoholindholdet i Europas brændstoffer reducere kulstofemissionerne
- Kina ser højteknologisk militær, siger, at USA underminerer global stabilitet
- Er alle planeter lyse genstande på himlen?


