Hvordan opfører elektronerne sig i et mineral med metallisk binding?
1. Delokaliseret elektronhav: I modsætning til i ioniske eller kovalente bindinger, hvor elektroner er lokaliseret mellem specifikke atomer, involverer metalliske bindinger et "hav" af delokaliserede elektroner. Disse elektroner er ikke forbundet med noget bestemt atom og er frie til at bevæge sig gennem hele krystalgitteret.
2. Høj elektrisk ledningsevne: De delokaliserede elektroner kan let bevæge sig under påvirkning af et elektrisk felt, hvilket gør metaller fremragende ledere af elektricitet. Dette skyldes, at elektronerne let kan bære ladning i hele materialet.
3. Høj termisk ledningsevne: De frit bevægende elektroner kan også overføre termisk energi effektivt, hvilket gør metaller til gode ledere af varme.
4. Malbarhed og duktilitet: De delokaliserede elektroner fungerer som en "lim", der holder metalionerne sammen. Når en kraft påføres, kan ionerne glide forbi hinanden uden at bryde bindingerne. Dette gør det muligt for metaller let at formes (formbar) og tegnes i ledninger (duktil).
5. Luster: De delokaliserede elektroner kan absorbere og genemitere lys, hvilket giver metaller deres karakteristiske skinnende udseende eller glans.
6. Opacitet: De frie elektroner absorberer en lang række bølgelængder af lys, hvilket forhindrer lys i at passere gennem materialet. Dette er grunden til, at de fleste metaller er uigennemsigtige.
7. Relativt høje smelte- og kogepunkter: De stærke attraktive kræfter mellem de positivt ladede metalioner og det negativt ladede elektronhav kræver en betydelig mængde energi for at bryde, hvilket resulterer i høje smelte- og kogepunkter for de fleste metaller.
Kortfattet: De delokaliserede elektroner i et metal skaber et unikt sæt egenskaber, der gør metaller nyttige til en lang række anvendelser.
 Varme artikler
Varme artikler
-
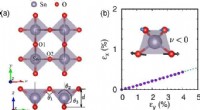 Forskere laver teoretisk forudsigelse af 2-D halvleder tindioxidFig. 1. (a) Atomstrukturen af et 2D δ-SnO2-monolag. (b) Stammen i x -retningen som følge af en påført trækbelastning i y -retningen. Kredit:JIANG Peng For nylig, Prof. 2 ) enkeltlagsfase (P-4
Forskere laver teoretisk forudsigelse af 2-D halvleder tindioxidFig. 1. (a) Atomstrukturen af et 2D δ-SnO2-monolag. (b) Stammen i x -retningen som følge af en påført trækbelastning i y -retningen. Kredit:JIANG Peng For nylig, Prof. 2 ) enkeltlagsfase (P-4 -
 Metoden undersøger hurtigt atomtynde materialers evne til at producere brintEn teknik udviklet af Rice University og Los Alamos National Laboratory vil give forskere mulighed for hurtigt at undersøge atomtykke materialer for at måle brintproduktion. Rislaboratoriet bruger en
Metoden undersøger hurtigt atomtynde materialers evne til at producere brintEn teknik udviklet af Rice University og Los Alamos National Laboratory vil give forskere mulighed for hurtigt at undersøge atomtykke materialer for at måle brintproduktion. Rislaboratoriet bruger en -
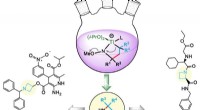 Kemikere viser, at hoften er firkantetRice University kemikere udviklede en syntetisk vej til azetidiner, molekyler, der eksponerer nitrogenatomer, der fungerer som forløbere for lægemiddeldesign. Kredit:László Kürti/Rice University R
Kemikere viser, at hoften er firkantetRice University kemikere udviklede en syntetisk vej til azetidiner, molekyler, der eksponerer nitrogenatomer, der fungerer som forløbere for lægemiddeldesign. Kredit:László Kürti/Rice University R -
 Er antivitaminer det nye antibiotika?Kredit:CC0 Public Domain Antibiotika er blandt de vigtigste opdagelser af moderne medicin og har reddet millioner af liv siden opdagelsen af penicillin for næsten 100 år siden. Mange sygdomme fo
Er antivitaminer det nye antibiotika?Kredit:CC0 Public Domain Antibiotika er blandt de vigtigste opdagelser af moderne medicin og har reddet millioner af liv siden opdagelsen af penicillin for næsten 100 år siden. Mange sygdomme fo
- Hvordan kan du stå på Jorden forklare?
- Hvad kaldes ændringen fra et fast stof direkte til gas?
- Når friskvandsprotozoa pumper ud, hvor får det energien til at gøre det?
- Hvad er der placeret ved 33 grader nordlig breddegrad og 86 vestlig længdegrad?
- Forskere stryger rynker af grafen
- Er der andre planeter Andromeda Galaxy?


