Hvorfor opløses acetanilid i HCI?
* acetanilid er en neutral forbindelse: Det har ikke nogen grundlæggende eller sure funktionelle grupper, der let ville reagere med HCL.
* HCL er en stærk syre: Selvom det kan protonere nogle forbindelser, reagerer det ikke med acetanilid på en måde, der ville føre til betydelig opløselighed.
Hvad sker der faktisk:
* Acetanilid er en organisk forbindelse med en relativt lav polaritet. Det er mere opløseligt i organiske opløsningsmidler som ethanol eller acetone.
* HCL er et polært opløsningsmiddel.
* Forskellen i polaritet mellem acetanilid og HCI betyder, at de ikke er blandbare, og acetanilid opløses ikke i HCI.
Hvorfor tror du måske, at det opløses:
* Mulig forvirring: Nogle mennesker kan forveksle acetanilid med anilin (C6H5NH2). Anilin, med sin amingruppe, * kan * reagere med HCL for at danne et opløseligt salt.
* opløselighed under andre sure forhold: Mens acetanilid ikke er opløseligt i HCI, kan det * opløses i stærke sure opløsninger som koncentreret svovlsyre (H2SO4). Dette skyldes protonering af carbonylgruppen i acetanilid, hvilket gør det mere polært og tillader det at opløses.
Kortfattet: Acetanilid opløses ikke i HCI på grund af dets neutrale natur og mangel på en stærk interaktion med syren. Det er mere opløseligt i organiske opløsningsmidler.
Sidste artikelHvordan relaterer bølgelængden af maksimal absorbans til at farve et stof?
Næste artikelHvad er farven på zinksulfid?
 Varme artikler
Varme artikler
-
 To simple byggeklodser producerer komplekst 3D-materialeSelvmontering af et metal-organisk stel. Kredit:Northwestern University Forskere fra Northwestern University har bygget et strukturelt komplekst materiale fra to simple byggesten, der er den metal
To simple byggeklodser producerer komplekst 3D-materialeSelvmontering af et metal-organisk stel. Kredit:Northwestern University Forskere fra Northwestern University har bygget et strukturelt komplekst materiale fra to simple byggesten, der er den metal -
 Ny type plast fremstillet af genvundet affaldSammensat og granuleret polyhydroxybutyrat (PHB). Kredit:Fraunhofer-Gesellschaft En ny type plast fremstillet af genvundet affald nedbrydes let på mindre end et år. Det stof, der snart vil tjene t
Ny type plast fremstillet af genvundet affaldSammensat og granuleret polyhydroxybutyrat (PHB). Kredit:Fraunhofer-Gesellschaft En ny type plast fremstillet af genvundet affald nedbrydes let på mindre end et år. Det stof, der snart vil tjene t -
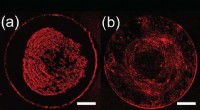 Ny fremstillingsteknik kan forbedre det almindelige problem inden for printteknologiFor figur A, der er partikeltransport til spidsen af måldråben, og der dannes en tæt midteraflejring. For figur B, den endelige kortlagte indbetaling er mere ensartet. Kredit: Langmuir En ny fr
Ny fremstillingsteknik kan forbedre det almindelige problem inden for printteknologiFor figur A, der er partikeltransport til spidsen af måldråben, og der dannes en tæt midteraflejring. For figur B, den endelige kortlagte indbetaling er mere ensartet. Kredit: Langmuir En ny fr -
 Hvorfor hviler makrofager i sundt vævEn makrofag i en pore, der måler 20 mikrometer på tværs (elektronmikroskopbillede). Kredit:ETH Zürich / Nikhil Jain og Isabel Gerber ETH -forskere har vist, at immunsystemets makrofager ikke kun r
Hvorfor hviler makrofager i sundt vævEn makrofag i en pore, der måler 20 mikrometer på tværs (elektronmikroskopbillede). Kredit:ETH Zürich / Nikhil Jain og Isabel Gerber ETH -forskere har vist, at immunsystemets makrofager ikke kun r
- Japans største komplette dinosaurskelet kommer til live
- Hvordan er du mindst for at storme blå lys røntgenbilleder mikrobølger orange infrarød stråling…
- Robot -pingpongtræner hjælper spillere med at spille bordtennis
- Internationalt team udvikler en ny DNA-nanomotor
- Hvordan vil placeringen af sol på H-R-diagram ændre sig, når den bliver en rød kæmpe?
- Hvis en læskedrik indeholder høje koncentrationer af sukker og kuldioxid, hvad kunne der ske, hvis…


