Hvorfor natriumchlorid vil udføre elektricitet, når den er smeltet?
* ionisk binding: Natriumchlorid er en ionisk forbindelse, hvilket betyder, at det dannes af den elektrostatiske tiltrækning mellem positivt ladede natriumioner (Na+) og negativt ladede chloridioner (Cl-).
* solid tilstand: I sin faste tilstand holdes ionerne i en stiv, krystallinsk gitter. Denne ordning forhindrer ioner i at bevæge sig frit, hvilket gør det til en isolator.
* smeltet tilstand: Når de opvarmes til dets smeltepunkt, svækkes de stærke ioniske bindinger, hvilket giver ionerne mulighed for at bryde fri fra gitteret. Disse gratis, mobile ioner kan nu bære en elektrisk strøm.
* ledningsmekanisme: Når et elektrisk potentiale påføres, migrerer de positive natriumioner mod den negative elektrode (katode), og de negative chloridioner migrerer mod den positive elektrode (anode). Denne strøm af ladede partikler udgør en elektrisk strøm.
I resumé stammer evnen til smeltet natriumchlorid til at lede elektricitet fra tilstedeværelsen af frie, mobile ioner, der kan bære ladningen.
Sidste artikelHvad er den molære masse af Agcro4?
Næste artikelTre indikatorer for, at der er sket kemiske ændringer?
 Varme artikler
Varme artikler
-
 Videnskab ved grænsefladen:Bioinspirerede materialer afslører nyttige egenskaberNy forskning af Brian Wadsworth, Gary Moore og deres kolleger pryder forsiden af tidsskriftet ACS Materials &Interfaces. Inspireret af naturen, hvor aminosyrerester og bløde materialers koordination
Videnskab ved grænsefladen:Bioinspirerede materialer afslører nyttige egenskaberNy forskning af Brian Wadsworth, Gary Moore og deres kolleger pryder forsiden af tidsskriftet ACS Materials &Interfaces. Inspireret af naturen, hvor aminosyrerester og bløde materialers koordination -
 En ny metode til kvantitativ vurdering af graden af lighed af koordineringspolyederTrekanterne angiver CPerne svarende til trigonal bipyramid, og de åbne og grå firkanter angiver tetragonal pyramide med det centrale atom i basen og i centrum af massen, henholdsvis. Kredit:Lobachevsk
En ny metode til kvantitativ vurdering af graden af lighed af koordineringspolyederTrekanterne angiver CPerne svarende til trigonal bipyramid, og de åbne og grå firkanter angiver tetragonal pyramide med det centrale atom i basen og i centrum af massen, henholdsvis. Kredit:Lobachevsk -
 Modulerende spiralformede nanostrukturer i flydende krystalfase ved molekylært designKredit:Unsplash/CC0 Public Domain Et team af forskere ledet af adjunkt Yuki Arakawa (Toyohashi University of Technology, Japan) har med succes udviklet svovlholdige flydende krystal (LC) dimermole
Modulerende spiralformede nanostrukturer i flydende krystalfase ved molekylært designKredit:Unsplash/CC0 Public Domain Et team af forskere ledet af adjunkt Yuki Arakawa (Toyohashi University of Technology, Japan) har med succes udviklet svovlholdige flydende krystal (LC) dimermole -
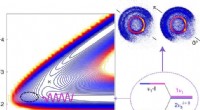 Brug af kvantevibrationsegenskaber mellem molekyler til at fremskynde reaktioner mellem forbindelserGrafisk abstrakt. Kredit:Nature Chemistry (2022). DOI:10.1038/s41557-022-00914-3 Et par forskere, den ene med Southern University of Science and Technology, den anden Institute of Atomic and Molecu
Brug af kvantevibrationsegenskaber mellem molekyler til at fremskynde reaktioner mellem forbindelserGrafisk abstrakt. Kredit:Nature Chemistry (2022). DOI:10.1038/s41557-022-00914-3 Et par forskere, den ene med Southern University of Science and Technology, den anden Institute of Atomic and Molecu
- Hvad er niobium, det er en fast væske eller gas?
- Hvad er trinene til at beskytte miljøet?
- Ny mikroskopi teknik kortlægger mekaniske egenskaber af levende celler
- Teenagemødre i Sydafrika:Største undersøgelse nogensinde undersøger, hvad der skal til for at gå…
- At opretholde stærke fællesskabsbånd øger overlevelsesraterne efter en krise
- Hvad er farven på plastisk svovl?


