Er borsyre opløselig i ethanol?
Her er hvorfor:
* Polaritet: Både borsyre og ethanol er polære molekyler. Borsyre har en polær B-O-binding, mens ethanol har en polær O-H-binding. Denne lighed i polaritet giver dem mulighed for at interagere positivt gennem dipol-dipol-interaktioner.
* Hydrogenbinding: Ethanol kan danne brintbindinger med borsyre. Hydrogenatomet på hydroxylgruppen af ethanol kan danne en brintbinding med iltatomet i borsyre.
Opløseligheden af borsyre i ethanol er ikke ekstremt høj, men den er markant mere opløselig i ethanol end i vand.
Bemærk: Opløseligheden af borsyre i ethanol kan variere afhængigt af koncentrationen af borsyre og temperaturen.
 Varme artikler
Varme artikler
-
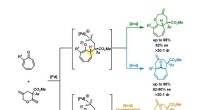 Divergent syntese af bicykliske mellemstore ringstrukturerFigur viser reaktionsvejene for den divergerende syntese af tre klasser af forbindelser. Ved at bruge det samme sæt af udgangsmaterialer og palladiumkatalysator, men udsat for forskellige reaktionsbet
Divergent syntese af bicykliske mellemstore ringstrukturerFigur viser reaktionsvejene for den divergerende syntese af tre klasser af forbindelser. Ved at bruge det samme sæt af udgangsmaterialer og palladiumkatalysator, men udsat for forskellige reaktionsbet -
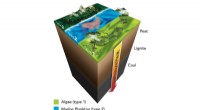 Forskere bruger røntgenstråler til at knække skiferens hemmeligheder, en hjørnesten i en af na…Som vist i denne illustration, som kulstof som det der findes i alger, marine plankton og kystnære landplanter bevæger sig tættere på Jordens kerne, det udsættes for højere temperaturer og tryk, der æ
Forskere bruger røntgenstråler til at knække skiferens hemmeligheder, en hjørnesten i en af na…Som vist i denne illustration, som kulstof som det der findes i alger, marine plankton og kystnære landplanter bevæger sig tættere på Jordens kerne, det udsættes for højere temperaturer og tryk, der æ -
 Optisk mikroskopstrategi giver observatører mulighed for at kontrollere elektroner, der bevæger si…Kredit:CC0 Public Domain Et hold ledet af DGIST-professor Seo Dae-ha har udviklet en eksperimentel strategi til at kontrollere og observere den kemiske reaktion af en enkelt nanokatalysator ved hjæ
Optisk mikroskopstrategi giver observatører mulighed for at kontrollere elektroner, der bevæger si…Kredit:CC0 Public Domain Et hold ledet af DGIST-professor Seo Dae-ha har udviklet en eksperimentel strategi til at kontrollere og observere den kemiske reaktion af en enkelt nanokatalysator ved hjæ -
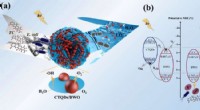 Forskere udvikler Z-skema katalysator for forurenende stoffer i vandSkematisk illustration af fotokatalytisk mekanisme. Kredit:YANG Pengqi I de seneste år, den hurtige industrialisering har forårsaget stadig mere alvorlig miljøforurening. Antibiotika og mikrobiolo
Forskere udvikler Z-skema katalysator for forurenende stoffer i vandSkematisk illustration af fotokatalytisk mekanisme. Kredit:YANG Pengqi I de seneste år, den hurtige industrialisering har forårsaget stadig mere alvorlig miljøforurening. Antibiotika og mikrobiolo
- Hvordan forskere bruger droner til at sænke risikoen for katastrofale oversvømmelser fra store gle…
- Hvad er 375 Fahrenheit?
- FN tager skridt mod en global miljøpagt, som USA er imod
- Visualisering af kemiske reaktioner med infrarød termografi
- Hvad kaldes bjergene på måne?
- Forskere visualiserer, hvordan bakterier taler med hinanden


