Hvorfor små molekyle - proteininteraktioner generelt er domnineret af hydrofobe interaktioner?
* vandmiljøet: Proteiner findes i det vandige miljø i cellen. Vandmolekyler er polære og danner brintbindinger med hinanden. Ikke-polære molekyler, som kulbrinter, forstyrrer disse brintbindinger, hvilket gør dem ugunstige i et vandigt miljø.
* minimering af forstyrrelse: For at minimere denne forstyrrelse har ikke-polære molekyler en tendens til at klynge sig sammen og skubbe vandmolekyler væk. Dette er kendt som hydrofobe effekt .
* bindende steder: Proteiner har ofte lommer eller kløfter kaldet bindingssteder, der er designet til at rumme små molekyler. Disse bindingssteder er ofte foret med ikke-polære aminosyrer (som valin, leucin, isoleucin, phenylalanin). Dette hydrofobe miljø inden for bindingsstedet favoriserer interaktionen med ikke-polære små molekyler.
* gunstige interaktioner: Mens hydrofobe interaktioner ikke er så stærke som ioniske bindinger eller hydrogenbindinger, bidrager de væsentligt til binding af stabilitet. Den hydrofobe effekt bidrager til den samlede frie energiændring af bindingsprocessen, hvilket gør interaktionen gunstig.
Andre faktorer:
* form komplementaritet: Formen på det lille molekyle og bindingsstedet skal være komplementært til vellykket binding.
* Elektrostatiske interaktioner: Mens mindre dominerende end hydrofobe interaktioner, spiller elektrostatiske interaktioner (ioniske bindinger, brintbindinger) også en rolle, især i dannelsen af den indledende interaktion og finjustering af komplekset.
* van der Waals Forces: Disse svage kræfter på kort afstand bidrager til den samlede stabilitet af interaktionen.
Kortfattet:
Hydrofobe interaktioner er afgørende i små molekyle-protein-interaktioner, fordi de driver forbindelsen af ikke-polære molekyler inden for proteinets hydrofobe bindingssteder, hvilket fører til gunstig binding og et stabilt kompleks. Mens andre interaktioner bidrager, er hydrofobe interaktioner ofte dominerende på grund af det vandige miljø, hvor proteiner fungerer.
 Varme artikler
Varme artikler
-
 At finde nyt liv til vin-drue-resterKredit:CC0 Public Domain Californien producerer næsten 4 millioner tons vin i verdensklasse hvert år, men med det kommer tusindvis af tons af rester som drueskind, frø, stængler og frugtkød. Hvad
At finde nyt liv til vin-drue-resterKredit:CC0 Public Domain Californien producerer næsten 4 millioner tons vin i verdensklasse hvert år, men med det kommer tusindvis af tons af rester som drueskind, frø, stængler og frugtkød. Hvad -
 Team beviser begrebet en naturlig tilgang til antiperspiranterThe Nature-Inspired Fluids and Interfaces Lab skabte et simuleret svedkirteleksperiment for at teste teorien om naturlig tilstopning af porer. Kredit:Virginia Tech Sveden er en naturlig funktion a
Team beviser begrebet en naturlig tilgang til antiperspiranterThe Nature-Inspired Fluids and Interfaces Lab skabte et simuleret svedkirteleksperiment for at teste teorien om naturlig tilstopning af porer. Kredit:Virginia Tech Sveden er en naturlig funktion a -
 High-throughput platform muliggør aktivitetskortlægning af nye kræftlægemålEn lysin -methyltransferase fastgjort til et substrat. Den tændte del viser en methylgruppe, der tilsættes af methyltransferasen. Kredit:Dr. Bradley Dickson/Rothbart Laboratory ved Van Andel Research
High-throughput platform muliggør aktivitetskortlægning af nye kræftlægemålEn lysin -methyltransferase fastgjort til et substrat. Den tændte del viser en methylgruppe, der tilsættes af methyltransferasen. Kredit:Dr. Bradley Dickson/Rothbart Laboratory ved Van Andel Research -
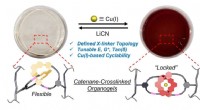 Sammenlåsende ringe låser op for nye materialeegenskaberAmatørkemikere husker måske, at kobber (Cu) normalt fremstår blåt i vand og grønt, når det er bundet af en standard ikke-aromatisk ligand. Men i tilfældet med de metalholdige catenaner, der er skabt i
Sammenlåsende ringe låser op for nye materialeegenskaberAmatørkemikere husker måske, at kobber (Cu) normalt fremstår blåt i vand og grønt, når det er bundet af en standard ikke-aromatisk ligand. Men i tilfældet med de metalholdige catenaner, der er skabt i


