Hvorfor er NH3 en svag elektrolyt?
* ligevægt: NH₃ reagerer med vand til dannelse af ammoniumioner (NH₄⁺) og hydroxidioner (OH⁻):
`` `
NH₃ (aq) + H₂O (L) ⇌ NH₄⁺ (aq) + OH⁻ (aq)
`` `
Denne reaktion når en ligevægt, hvilket betyder, at den ikke går til færdig. En betydelig mængde NH₃ forbliver uudskilt i opløsning.
* Lav ioniseringskonstant: Ligevægtskonstanten for denne reaktion, kaldet basisioniseringskonstanten (KB), er relativt lille (KB =1,8 x 10⁻⁵). Dette indikerer, at ligevægten favoriserer reaktanterne (NH₃ og H₂O) over produkterne (NH₄⁺ og OH⁻), hvilket kun betyder en lille procentdel af NH₃ -molekyler ioniser.
* svag base: Ammoniak fungerer som en svag base, fordi den accepterer protoner (H⁺) fra vand, men det gør det i et begrænset omfang. Denne begrænsede protonaccept fører til lav ledningsevne.
I modsætning hertil ioniserer stærke elektrolytter som stærke syrer og stærke baser fuldstændigt i opløsningen, hvilket resulterer i høj ledningsevne.
Nøgle takeaways:
* Svage elektrolytter som ammoniak ioniserer delvist, hvilket resulterer i en lavere koncentration af ioner og lavere ledningsevne.
* Ligevægtskonstanten for ionisering er relativt lille, hvilket indikerer en præference for den ikke-ioniserede form.
* Svage elektrolytter er typisk svage syrer eller svage baser.
 Varme artikler
Varme artikler
-
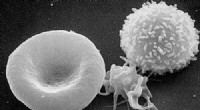 Stort gennembrud i fremstillingen af røde blodlegemerScanning elektronmikrografi af blodceller. Fra venstre mod højre:human erytrocyt, trombocyt (blodplader), leukocyt. Kredit:offentlig ejendom Forskere har genereret de første udødelige cellelinjer,
Stort gennembrud i fremstillingen af røde blodlegemerScanning elektronmikrografi af blodceller. Fra venstre mod højre:human erytrocyt, trombocyt (blodplader), leukocyt. Kredit:offentlig ejendom Forskere har genereret de første udødelige cellelinjer, -
 Forskere udfolder hemmelig stabilitet af bøjede sugerørUMass Amherst materialeforskere, med kolleger hos Virginia Tech, mener, at deres er den første undersøgelse, der undersøger, hvordan og hvorfor strukturer som bøjelige sugerør og sammenklappelige hund
Forskere udfolder hemmelig stabilitet af bøjede sugerørUMass Amherst materialeforskere, med kolleger hos Virginia Tech, mener, at deres er den første undersøgelse, der undersøger, hvordan og hvorfor strukturer som bøjelige sugerør og sammenklappelige hund -
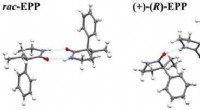 Forskere udvikler et lægemiddel, der stopper kramperStrukturen af 3-ethyl-2-phenylpyrrolidin-2-on (EPP). Kredit:Victor Khrustalev Forskere fra RUDN University deltog aktivt i udviklingen af en kemisk forbindelse til at stoppe kramper under epil
Forskere udvikler et lægemiddel, der stopper kramperStrukturen af 3-ethyl-2-phenylpyrrolidin-2-on (EPP). Kredit:Victor Khrustalev Forskere fra RUDN University deltog aktivt i udviklingen af en kemisk forbindelse til at stoppe kramper under epil -
 Osmiumaktivering i kræftcellerEn ny familie af osmiumforbindelser med kemisk reaktivitet inde i kræftcellen. Kredit:Scixel Kræft er en kompleks sygdom, og som sådan, der er ingen enkelt måde at tackle det på. Mens kræftbehandl
Osmiumaktivering i kræftcellerEn ny familie af osmiumforbindelser med kemisk reaktivitet inde i kræftcellen. Kredit:Scixel Kræft er en kompleks sygdom, og som sådan, der er ingen enkelt måde at tackle det på. Mens kræftbehandl
- Typer af fysisk miljø
- Hybrid tilgang forudsiger og bekræfter strukturen af komplekse metal nanopartikler
- Undersøgelsen identificerer faktorer, der forudsiger modstand mod Black Lives Matter Movement
- Finjustering af magnetisk spin for hurtigere, mindre hukommelsesenheder
- Hvilken er sand varme kan rejse godt gennem alle materialer eller nogle materialer?
- Hvor mange molekyler er der i iltgas?


