Hvordan er elektronstrukturen ens i fluor og klor?
* begge har 7 valenselektroner: De har hver 7 elektroner i deres yderste skal (det højeste energiniveau). Det er det, der gør dem meget reaktive og ivrige efter at få endnu en elektron for at opnå en stabil oktetkonfiguration.
Her er en sammenbrud af deres elektronkonfigurationer:
* fluor (F): 1S² 2S² 2P⁵
* klor (Cl): 1S² 2S² 2P⁶ 3S² 3P⁵
Ligheder:
* Begge har 5 elektroner i deres yderste P -underskaller.
* Begge er en elektron væk fra at have en komplet oktet, hvilket gør dem meget elektronegative.
* Begge danner let negative ioner med en ladning på -1 (f⁻ og cl⁻).
Forskelle:
* Antal elektronskaller: Klor har tre elektronskaller, mens fluor kun har to. Dette skyldes den større atomradius af klor, der giver mulighed for flere elektronskaller.
* Energiniveau: Valenselektroner i klor er på et højere energiniveau end dem i fluor på grund af den større størrelse af klor.
Kortfattet: På trods af forskellene i deres atomstørrelse og energiniveau har fluor og klor en lignende elektronstruktur i deres yderste skal, der tegner sig for deres lignende kemiske egenskaber og reaktivitet.
Sidste artikelHvad er den blok, som inerte gasser tilhører?
Næste artikelHvad er det samme med elektronisk struktur af lithium og natrium?
 Varme artikler
Varme artikler
-
 Simpel metode måler, hvor længe bakterier kan vente på antibiotikaEn farvet scanningselektronmikrograf af MRSA. Kredit:National Institute of Allergy and Infectious Diseases Et stigende antal patogener udvikler resistens over for et eller flere antibiotika, truer
Simpel metode måler, hvor længe bakterier kan vente på antibiotikaEn farvet scanningselektronmikrograf af MRSA. Kredit:National Institute of Allergy and Infectious Diseases Et stigende antal patogener udvikler resistens over for et eller flere antibiotika, truer -
 Forskere afslører metode til at omdanne metangas til flydende methanolOmdannelsen fandt sted under omgivende temperatur- og trykforhold, hvilket kunne gøre det muligt at bruge metan, en potent drivhusgas, til at producere brændstof. Kredit:UFSCAR Det er lykkedes en g
Forskere afslører metode til at omdanne metangas til flydende methanolOmdannelsen fandt sted under omgivende temperatur- og trykforhold, hvilket kunne gøre det muligt at bruge metan, en potent drivhusgas, til at producere brændstof. Kredit:UFSCAR Det er lykkedes en g -
 Ny katalysator til elektrokemisk selektiv C=O-hydrogenering af kanelaldehydHRTEM og elementær kortlægningsresultater af Pt-MoO3 /C. Kredit:Wang Jialu Forskere fra Institute of Solid State Physics, Hefei Institutes of Physical Science ved det kinesiske videnskabsakademi, r
Ny katalysator til elektrokemisk selektiv C=O-hydrogenering af kanelaldehydHRTEM og elementær kortlægningsresultater af Pt-MoO3 /C. Kredit:Wang Jialu Forskere fra Institute of Solid State Physics, Hefei Institutes of Physical Science ved det kinesiske videnskabsakademi, r -
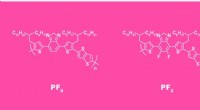 Forskere opgraderer organiske solceller til brug i tagsten, der producerer strømStrukturen af en gentagende enhed i polymerkæden uden fluor (venstre) og efter fluorering (højre). Kredit:Elena Khavina/MIPT Et internationalt team af materialeforskere fra Frankrig, Rusland og
Forskere opgraderer organiske solceller til brug i tagsten, der producerer strømStrukturen af en gentagende enhed i polymerkæden uden fluor (venstre) og efter fluorering (højre). Kredit:Elena Khavina/MIPT Et internationalt team af materialeforskere fra Frankrig, Rusland og
- Hvorfor rejser et snurrende æg sig?
- Hvad indeholder magnesuim carbonat?
- Hvordan hjælper fossilerne i klippelag forskere med at identificere Rock Age?
- Styring af en hvirvel ved hjælp af polymerer
- Dette er tungt:Kilogrammet får en opdatering
- Tungt vand:Hvordan smeltende iskapper og oppumpet grundvand kan sænke lokale havniveauer - og øge …


