Hvordan kan ioner beskrives?
Grundlæggende beskrivelse:
* ladede atomer eller molekyler: Ioner er atomer eller molekyler, der har opnået eller mistet elektroner, hvilket resulterer i en netto elektrisk ladning.
* kationer vs. anioner:
* kationer er positivt ladede ioner dannet, når et atom mister elektroner.
* anioner er negativt ladede ioner dannet, når et atom får elektroner.
* ioniske bindinger: Ioner danner ofte ioniske bindinger med modsat ladede ioner og skaber ioniske forbindelser.
mere detaljeret beskrivelse:
* opladning: Anklagen for en ion er repræsenteret af et superscript -nummer efterfulgt af et plus- eller minus -tegn. For eksempel har Na + en +1 -afgift, mens CL- har en -1 -afgift.
* størrelse: Ioner er generelt mindre end deres neutrale atomer. Kationer er mindre end deres tilsvarende neutrale atomer, fordi de har mistet elektroner, mens anioner er større, fordi de har vundet elektroner.
* reaktivitet: Ioner er meget reaktive på grund af deres ubalancerede afgifter. De har en tendens til at deltage i kemiske reaktioner for at opnå en stabil elektronisk konfiguration.
* Typer: Ioner kan klassificeres i forskellige typer baseret på deres ladning, størrelse og kemiske egenskaber. For eksempel er der monoatomiske ioner (dannet af enkeltatomer) og polyatomiske ioner (dannet fra grupper af atomer).
Eksempler:
* natriumion (Na+): En positivt ladet ion dannet, når et natriumatom mister en elektron.
* chloridion (Cl-): En negativt ladet ion dannet, når et chloratom får en elektron.
* calciumion (Ca2+): En positivt ladet ion dannet, når et calciumatom mister to elektroner.
* hydroxidion (OH-): Et negativt ladet polyatomisk ion dannet af et hydrogenatom og et iltatom.
Nøglekoncepter:
* Elektronegativitet: Et atomes evne til at tiltrække elektroner i en kemisk binding. Højere elektronegativitet gør det lettere for et atom at vinde elektroner og danne en anion.
* Elektronkonfiguration: Arrangementet af elektroner i et atom. Ioner stræber efter at opnå en stabil elektronkonfiguration, der typisk ligner en ædelgas.
At forstå disse beskrivelser hjælper dig med at forstå arten og opførslen af ioner i forskellige kemiske processer.
 Varme artikler
Varme artikler
-
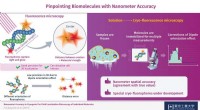 Udpegning af biomolekyler med nanometer nøjagtighedNanometer nøjagtighed i fjernfelts fluorescenslokaliseringsmikroskopi af to fluoroforer bundet til begge ender af 30 basepar af et dobbeltstrenget DNA (dsDNA) molekyle blev demonstreret ved at bruge k
Udpegning af biomolekyler med nanometer nøjagtighedNanometer nøjagtighed i fjernfelts fluorescenslokaliseringsmikroskopi af to fluoroforer bundet til begge ender af 30 basepar af et dobbeltstrenget DNA (dsDNA) molekyle blev demonstreret ved at bruge k -
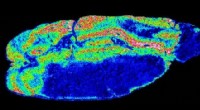 Konjugerede polymerer forbedrer massespektrometri og billeddannelseblå). Kredit:American Chemical Society Forbedringer i, hvordan prøver fremstilles, vil tilføje rækkevidde og fleksibilitet til en metode, der detekterer placeringen af udvalgte molekyler i en bi
Konjugerede polymerer forbedrer massespektrometri og billeddannelseblå). Kredit:American Chemical Society Forbedringer i, hvordan prøver fremstilles, vil tilføje rækkevidde og fleksibilitet til en metode, der detekterer placeringen af udvalgte molekyler i en bi -
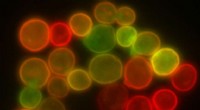 Forskere henter bagergær i jagten på ny medicinGærceller mærket med farverige fluorescerende markører er vist. Kredit:Wikimedia Commons (Public Domain) En af de sværeste dele af opdagelse af lægemidler er at fastlægge, hvordan en medicin fakti
Forskere henter bagergær i jagten på ny medicinGærceller mærket med farverige fluorescerende markører er vist. Kredit:Wikimedia Commons (Public Domain) En af de sværeste dele af opdagelse af lægemidler er at fastlægge, hvordan en medicin fakti -
 En saltopløsning til afsaltning af saltlageKredit:Pixabay/CC0 Public Domain Solcelledrevet saltlagekrystallisering kan afhjælpe miljøpåvirkningerne fra afsaltning af havvand. Behandling af spildlage ved hjælp af en selvrensende krystallis
En saltopløsning til afsaltning af saltlageKredit:Pixabay/CC0 Public Domain Solcelledrevet saltlagekrystallisering kan afhjælpe miljøpåvirkningerne fra afsaltning af havvand. Behandling af spildlage ved hjælp af en selvrensende krystallis
- Lys i mørket:Ny opdagelse gør mikroskopisk billeddannelse mulig under mørke forhold
- Verdens første grønne fodboldklub flytter målstængerne for, hvad der forventes af sportsinstitut…
- Hvorfor er kondens en vigtig proces i vandcyklussen?
- Varmemotor: Definition, typer og eksempler
- Hvad sker der med tidevandet under en solformørkelse?
- Jagten på udenjordisk liv i vandverdenerne tæt på hjemmet


