Hvordan adskiller isotoper af nitrogen sig fra ioner?
Isotoper af nitrogen:
* Definition: Isotoper er atomer med det samme element (nitrogen i dette tilfælde), der har det samme antal protoner (atomnummer), men forskellige antal neutroner. Dette betyder, at de har de samme kemiske egenskaber, men forskellige atommasser.
* Eksempler:
* nitrogen-14 (¹⁴n): Den mest almindelige isotop med 7 protoner og 7 neutroner.
* nitrogen-15 (¹⁵n): En isotop med 7 protoner og 8 neutroner.
* Nøgleegenskaber:
* Samme antal protoner (definerer elementet).
* Forskellige antal neutroner (påvirker atommasse).
* Identisk kemisk opførsel på grund af det samme antal elektroner.
ioner af nitrogen:
* Definition: Ioner er atomer eller molekyler, der har opnået eller mistet elektroner, hvilket giver dem en netto elektrisk ladning.
* Eksempler:
* nitrogenkation (n⁺): Et nitrogenatom, der har mistet et elektron, hvilket resulterer i en +1 ladning.
* nitridanion (n⁻³): Et nitrogenatom, der har fået tre elektroner, hvilket resulterer i en -3 -ladning.
* Nøgleegenskaber:
* Samme antal protoner (definerer elementet).
* Samme antal neutroner (medmindre ionen blev dannet fra en isotop).
* Forskellige antal elektroner (giver ion dens ladning).
* Forskellig kemisk opførsel på grund af det forskellige antal elektroner.
Kortfattet:
* isotoper adskiller sig i neutronnummer, hvilket fører til massevariationer.
* ioner adskiller sig i elektronantal, hvilket fører til ladningsvariationer.
Nøgleforskel: Isotoper er neutrale atomer, mens ioner oplades atomer eller molekyler. De er forskellige koncepter relateret til atomstruktur og adfærd.
Sidste artikelHvad er opløseligt nitrogen?
Næste artikelHvordan adskiller du nitrogengas fra en blanding af og flydende nitrogen?
 Varme artikler
Varme artikler
-
 Stabil forsyning af elektrokrom metallo-supramolekylær polymerDæmpende EC-glas bestående af en metallo-supramolekylær polymer. Kredit:National Institute for Materials Science National Institute for Materials Science (NIMS) og Tokyo Chemical Industry Co., Ltd
Stabil forsyning af elektrokrom metallo-supramolekylær polymerDæmpende EC-glas bestående af en metallo-supramolekylær polymer. Kredit:National Institute for Materials Science National Institute for Materials Science (NIMS) og Tokyo Chemical Industry Co., Ltd -
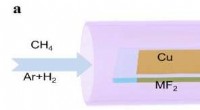 Fluor fremskynder todimensionel materialevækstSkematiske diagrammer over det eksperimentelle design til lokalt at introducere fluor til grafenvækst. Kredit:IBS Tilbage i 2004, fysikfællesskabet var lige begyndt at erkende eksistensen af vir
Fluor fremskynder todimensionel materialevækstSkematiske diagrammer over det eksperimentelle design til lokalt at introducere fluor til grafenvækst. Kredit:IBS Tilbage i 2004, fysikfællesskabet var lige begyndt at erkende eksistensen af vir -
 Innovationspionerer scorer verdens først for bæredygtigt byggeri med grafenbetonTeam fra University of Manchester og Nationwide Engineering om verdens første konstruerede grafenbeton i kommercielle omgivelser, kun et par kilometer øst for det gamle monument i Stonehenge, det nye
Innovationspionerer scorer verdens først for bæredygtigt byggeri med grafenbetonTeam fra University of Manchester og Nationwide Engineering om verdens første konstruerede grafenbeton i kommercielle omgivelser, kun et par kilometer øst for det gamle monument i Stonehenge, det nye -
 Hvordan protoner bevæger sig gennem en brændselscelleKredit:iStock Brint betragtes som fremtidens energikilde:Det produceres med solenergi og kan bruges til at generere varme og elektricitet i brændselsceller. Det er nu lykkedes for Empa -forskere a
Hvordan protoner bevæger sig gennem en brændselscelleKredit:iStock Brint betragtes som fremtidens energikilde:Det produceres med solenergi og kan bruges til at generere varme og elektricitet i brændselsceller. Det er nu lykkedes for Empa -forskere a
- NASA demonstrerer elektronik til længere Venus-overflademissioner
- Hvad var J Tuzo Wilsons teori?
- Grafencoating kan hjælpe med at forhindre brand i lithiumbatterier
- Hvor findes stratificerede pladeepitelceller?
- EPA kan ændre, hvordan den beregner de økonomiske virkninger af reguleringer
- En af Californiens mest risikable vulkaner er meget aktiv. Kommer der et udbrud?


