Hvad er massen på 150 liter nitrogengas (N2)?
1. Ideel gaslov:
* Den ideelle gaslov er en god tilnærmelse for gasser under normale forhold. Det siger: pv =nrt
* P =pres (i Pascals)
* V =volumen (i kubikmeter)
* n =antal mol
* R =ideel gaskonstant (8.314 j/mol · k)
* T =temperatur (i Kelvin)
2. Konverter enheder:
* bind: 150 liter =0,15 kubikmeter (1 liter =0,001 kubikmeter)
* Antag standardtemperatur og tryk (STP):
* Temperatur (t) =273,15 K (0 ° C)
* Tryk (P) =101325 PA (1 ATM)
3. Løs for mol (n):
* Omarranger den ideelle gaslovligning: n =(PV) / (RT)
* Udskift værdierne:N =(101325 PA * 0,15 m³) / (8.314 J / Mol · K * 273.15 K)
* Beregn:N ≈ 6,68 mol nitrogengas
4. Beregn masse:
* molmasse af n₂: 28,01 g/mol
* masse =mol * Molær masse: Masse ≈ 6,68 mol * 28,01 g/mol ≈ 187,05 g
Derfor er massen på 150 liter nitrogengas ved STP ca. 187,05 gram
Sidste artikelHvornår kondenseres vand?
Næste artikelHvad konverterer nitrogen i cyklussen?
 Varme artikler
Varme artikler
-
 Nyt materiale renser og spalter vandSamtidig fotokatalytisk brintgenerering og farvestofnedbrydning ved hjælp af et synligt lysaktivt metal-organisk rammeværk. Kredit:Alina-Stavroula Kampouri/EPFL Metal-organiske rammer (MOFer) er b
Nyt materiale renser og spalter vandSamtidig fotokatalytisk brintgenerering og farvestofnedbrydning ved hjælp af et synligt lysaktivt metal-organisk rammeværk. Kredit:Alina-Stavroula Kampouri/EPFL Metal-organiske rammer (MOFer) er b -
 Højtryksforskere opdager lovende materiale til informationsteknologiKredit:CC0 Public Domain Forskere ved University of Bayreuth har opdaget et usædvanligt materiale:Når det køles ned til to grader celsius, dets krystalstruktur og elektroniske egenskaber ændrer si
Højtryksforskere opdager lovende materiale til informationsteknologiKredit:CC0 Public Domain Forskere ved University of Bayreuth har opdaget et usædvanligt materiale:Når det køles ned til to grader celsius, dets krystalstruktur og elektroniske egenskaber ændrer si -
 Appellerende fund tyder på, hvorfor køling dæmper bananaromaerKredit:American Chemical Society Bananer er en af verdens mest populære frugter. Men hvordan de opbevares, før de når dagligvarehylderne, kan påvirke deres smag og lugt negativt. Nu i en undersø
Appellerende fund tyder på, hvorfor køling dæmper bananaromaerKredit:American Chemical Society Bananer er en af verdens mest populære frugter. Men hvordan de opbevares, før de når dagligvarehylderne, kan påvirke deres smag og lugt negativt. Nu i en undersø -
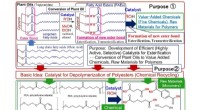 En højtydende katalysator, der opløser polyester og realiserer kemisk genbrugKatalysatorudvikling ikke kun til effektiv omdannelse af planteolier (FAEer) til værditilvækstkemikalier (finkemikalier) og råmaterialer til polymerer, men også til effektiv depolymerisering (kemisk g
En højtydende katalysator, der opløser polyester og realiserer kemisk genbrugKatalysatorudvikling ikke kun til effektiv omdannelse af planteolier (FAEer) til værditilvækstkemikalier (finkemikalier) og råmaterialer til polymerer, men også til effektiv depolymerisering (kemisk g
- Forskere definerer binære tropiske cykloner
- Supermassive sorte huller sætter en bremse på stjernefødsler
- Der er behov for dybe transformationer for at nå målene for bæredygtig udvikling
- Forskere finder, at bakterioplankton er afhængig af miljømæssigt vitamin B1 frem for at lave dere…
- Hvorfor er polymerer ikke -reaktive?
- Brug af multi-task læring til taleoversættelse med lav latency


