Hvorfor er det, at en opløselig fast prøve af natriumsalt ikke udfører elektricitet?
* ioniske forbindelser: Natriumsalt (NaCI) er en ionisk forbindelse. Dette betyder, at det består af positivt ladede natriumioner (Na+) og negativt ladede chloridioner (Cl-).
* solid tilstand: I fast tilstand er disse ioner arrangeret i en fast, stiv gitterstruktur. Mens der er gebyrer til stede, er de ikke frie til at flytte, så det faste stof kan ikke udføre elektricitet.
* opløsning i vand: Når natriumsalt opløses i vand, omgiver vandmolekylerne ionerne, bryder de ioniske bindinger og lader ionerne bevæge sig frit.
* Konduktivitet: Disse frit bevægende ioner er det, der får løsningen til at udføre elektricitet. Ionerne kan nu bære elektrisk ladning gennem opløsningen.
Kort sagt udfører en opløselig fast prøve af natriumsalt ikke elektricitet, fordi ionerne er låst i en stiv struktur. Men når de opløses i vand, bliver ionerne mobile og kan bære ladning, hvilket tillader løsningen at udføre elektricitet.
Sidste artikelHvilke andre elementer reagerer negativt med sølv?
Næste artikelHvad er mineraler lavet af?
 Varme artikler
Varme artikler
-
 Bakteriefabrikker bruges til at opdage potentielle nye malariamedicinDerivater af violacein. Kredit:Hung-En Lai Forskere har konstrueret bakterier til at producere nye versioner af et potentielt antibiotisk molekyle, nogle med kraftige antimalariaegenskaber. Brug
Bakteriefabrikker bruges til at opdage potentielle nye malariamedicinDerivater af violacein. Kredit:Hung-En Lai Forskere har konstrueret bakterier til at producere nye versioner af et potentielt antibiotisk molekyle, nogle med kraftige antimalariaegenskaber. Brug -
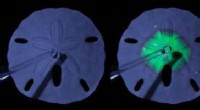 Fra søpindsvinskelet til solcellerDenne billedserie viser et skelet med sanddollar, der gradvist konverterer til en lysemitterende perovskit. Snapshots af denne konvertering er taget på 0s, 5s, 15erne, og 40erne. Kredit:Noorduin Lab,
Fra søpindsvinskelet til solcellerDenne billedserie viser et skelet med sanddollar, der gradvist konverterer til en lysemitterende perovskit. Snapshots af denne konvertering er taget på 0s, 5s, 15erne, og 40erne. Kredit:Noorduin Lab, -
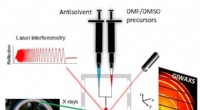 Røntgenstråler afslører in situ krystalvækst af blyfrie perovskit solpanelmaterialerEt skema over den eksperimentelle opsætning, der bruges til at undersøge den strukturelle dannelse af perovskites tynde film under spinbelægning. Kredit:G.Portale, University of Groningen Blybaser
Røntgenstråler afslører in situ krystalvækst af blyfrie perovskit solpanelmaterialerEt skema over den eksperimentelle opsætning, der bruges til at undersøge den strukturelle dannelse af perovskites tynde film under spinbelægning. Kredit:G.Portale, University of Groningen Blybaser -
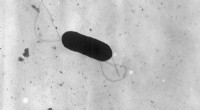 Stop listeria reproduktion i sine sporElektronmikrograf af en flagelleret Listeria monocytogenes -bakterie, Forstørret 41, 250X. Kredit:CDC/public domain Listeria -forureninger kan sende fødevareforarbejdningsfaciliteter i fuld krise
Stop listeria reproduktion i sine sporElektronmikrograf af en flagelleret Listeria monocytogenes -bakterie, Forstørret 41, 250X. Kredit:CDC/public domain Listeria -forureninger kan sende fødevareforarbejdningsfaciliteter i fuld krise
- Hvilket ville ikke ændre en potteplanter vækst?
- Tid til at udnytte COVID-19-forstyrrelser for at fastlåse grønnere adfærd
- Nyt nano-værktøj syntetiseret
- Ny BlackBerry -telefon har til formål at genoplive falmet mærke
- Upublicerede egyptiske tekster afslører ny indsigt i oldtidens medicin
- Ny teknologi til oprydning af olieudslip er testet med succes


