Hvad får ædle gasser til at tænde og afgive deres karakteristiske farve?
Sådan fungerer det:
1. Elektrisk strøm: Når en elektrisk strøm føres gennem en ædel gas, absorberer elektronerne i gasatomerne energi fra strømmen.
2. excitation: Denne energi øger elektronerne til højere energiniveau, en tilstand kendt som ophidset tilstand .
3. afslapning: De ophidsede elektroner er ustabile og vender hurtigt tilbage til deres jordtilstand, det lavere energiniveau.
4. fotonemission: Under afslapningsprocessen frigiver elektronerne den overskydende energi som lys, kaldet fotoner. Lysets farve afhænger af den specifikke energiforskel mellem de ophidsede og jordtilstande for elektronerne.
Forskellige ædle gasser udsender forskellige farver, fordi de har forskellige energiniveauer og overgange:
* helium (He): Udsender et lysegul-hvidt lys.
* neon (NE): Udsender et intensivt rød-orange lys, ofte forbundet med neonskilte.
* argon (AR): Udsender et lyse violet lys.
* krypton (KR): Udsender et hvidligt lys.
* Xenon (XE): Udsender et blåligt-hvidt lys.
Derfor er det ikke de ædle gasser selv, der lyser op, men snarere elektrisk excitation Det får deres elektroner til at udsende fotoner, hvilket resulterer i de karakteristiske farver, der er forbundet med hver gas.
 Varme artikler
Varme artikler
-
 Linsefri OLED'er med effektivitet sammenlignelig med uorganiske LED'erFigur 1. Fotografier af OLEDer med SiO2-indlejrede spredningslag i henhold til spredning. Kredit:Korea Advanced Institute of Science and Technology (KAIST) Brugen af organiske lysemitterende dio
Linsefri OLED'er med effektivitet sammenlignelig med uorganiske LED'erFigur 1. Fotografier af OLEDer med SiO2-indlejrede spredningslag i henhold til spredning. Kredit:Korea Advanced Institute of Science and Technology (KAIST) Brugen af organiske lysemitterende dio -
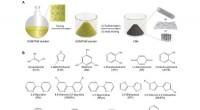 Forskerhold foreslår en effektiv strategi til fremstilling af kulstof nanomaterialerFig. 1:Fremstilling af CMer. (A) Skematisk illustration af forberedelsesprocessen for CMer. (B) Strukturer af de undersøgte SOMer til CM-forberedelsen. Kredit:University of Science and Technology of C
Forskerhold foreslår en effektiv strategi til fremstilling af kulstof nanomaterialerFig. 1:Fremstilling af CMer. (A) Skematisk illustration af forberedelsesprocessen for CMer. (B) Strukturer af de undersøgte SOMer til CM-forberedelsen. Kredit:University of Science and Technology of C -
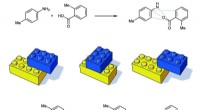 Et kort over reaktioner hjælper med at kontrollere molekylære egenskaberKredit:University of Michigan Kemiske reaktioner bruges til at producere alle slags vigtige molekyler såsom lægemidler, landbrugskemikalier og materialer. At skabe et lægemiddel med specifikke eg
Et kort over reaktioner hjælper med at kontrollere molekylære egenskaberKredit:University of Michigan Kemiske reaktioner bruges til at producere alle slags vigtige molekyler såsom lægemidler, landbrugskemikalier og materialer. At skabe et lægemiddel med specifikke eg -
 Hvorfor er planter grønne? Forskningsteams model gengiver fotosynteseUC Riverside-ledet forskerholds model til at forklare fotosyntese beskriver den næste udfordrende fase af forskningen om, hvordan grønne planter omdanner lysenergi til kemisk energi. Kredit:Gabor lab,
Hvorfor er planter grønne? Forskningsteams model gengiver fotosynteseUC Riverside-ledet forskerholds model til at forklare fotosyntese beskriver den næste udfordrende fase af forskningen om, hvordan grønne planter omdanner lysenergi til kemisk energi. Kredit:Gabor lab,
- Hvad er fordelene ved genanvendelse?
- Hvad er deres afgifter for protoner og neutroner?
- Hvad er den del af muskelsystemet?
- Hvor mange totale valenselektroner er der i puljen for fosfortrifluorid?
- Asiatiske karper, der er i stand til at overleve i meget større områder af Lake Michigan end tidli…
- Hvilken planet er lysere månen eller solen?


