Hvad er et eksempel på en reduktionsreaktion udført af celler, hvor hydrogen ikke til tilføjede den reducerede forbindelse?
Her er hvorfor:
* NAD+ (nicotinamid adenin dinucleotid) er en elektronbærer, der findes i to former:oxideret (NAD+) og reduceret (NADH).
* reduktion involverer gevinsten af elektroner. I dette tilfælde får NAD+ to elektroner og en proton (H+), der bliver NADH.
* Det tilsatte brint fastgøres imidlertid ikke direkte til NAD+ -molekylet. I stedet overføres elektronerne til nikotinamidringen af NAD+, mens protonen frigøres i den omgivende opløsning.
Selvom reaktionen involverer reduktion, tilsættes brint ikke direkte til den reducerede forbindelse (NADH).
Her er en forenklet sammenbrud:
* NAD + (oxideret) + 2 elektroner + H + → NADH (reduceret) + H +
Denne reaktion er afgørende for energiproduktion i celler. NADH bærer højenergi-elektronerne til elektrontransportkæden, hvor de bruges til at generere ATP, cellernes primære energi valuta.
Andre eksempler på reduktionsreaktioner uden direkte brinttilsætning:
* Ferredoxin -reduktion: Ferredoxin, en anden elektronbærer, bliver reduceret i fotosyntesen ved at acceptere elektroner uden direkte brinttilsætning.
* cytochrome reduktion: Cytokromer, der er involveret i elektrontransportkæden, gennemgår reduktion ved at acceptere elektroner uden hydrogentilsætning.
Disse eksempler viser, at reduktionsreaktioner i biologi kan forekomme på forskellige måder, og direkte brinttilsætning er ikke altid den definerende egenskab.
Sidste artikelHvad får ædle gasser til at tænde og afgive deres karakteristiske farve?
Næste artikelHvad er den kemiske formel af Jung?
 Varme artikler
Varme artikler
-
 Discovery kan være en game-changer for lægemidlerEt hold ledet af Florida International University kemiprofessor Raphael Raptis udviklede et jernbaseret materiale, der kan skelne chirale molekyler, der forekommer naturligt i højre- og venstrehåndede
Discovery kan være en game-changer for lægemidlerEt hold ledet af Florida International University kemiprofessor Raphael Raptis udviklede et jernbaseret materiale, der kan skelne chirale molekyler, der forekommer naturligt i højre- og venstrehåndede -
 Strækbart, nedbrydelige halvledereEn ny strækbar halvleder, illustreret her, består af syrededbrydelige halvlederfibre (grønne) indlejret i en gummiagtig, bionedbrydeligt polymer. Kredit:Tilpasset fra ACS Central Science 2019, DOI:1
Strækbart, nedbrydelige halvledereEn ny strækbar halvleder, illustreret her, består af syrededbrydelige halvlederfibre (grønne) indlejret i en gummiagtig, bionedbrydeligt polymer. Kredit:Tilpasset fra ACS Central Science 2019, DOI:1 -
 Nær-infrarøde reflekterende blandingsbelægninger har bedre optisk og køleydelseKredit:DOI:10.1016/j.solener.2021.06.061 Kinesiske forskere fandt for nylig, at en nær-infrarød reflekterende blandingscoating havde bedre optisk og køleydelse, derved reducerer den absorberede en
Nær-infrarøde reflekterende blandingsbelægninger har bedre optisk og køleydelseKredit:DOI:10.1016/j.solener.2021.06.061 Kinesiske forskere fandt for nylig, at en nær-infrarød reflekterende blandingscoating havde bedre optisk og køleydelse, derved reducerer den absorberede en -
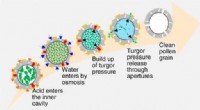 Rensning af pollenskallerKredit:American Chemical Society Efterhånden som allergisæsonen intensiveres, mange mennesker forbander pollen - det pulveragtige stof, der frigives af planter til reproduktion. Imidlertid, pollen
Rensning af pollenskallerKredit:American Chemical Society Efterhånden som allergisæsonen intensiveres, mange mennesker forbander pollen - det pulveragtige stof, der frigives af planter til reproduktion. Imidlertid, pollen
- Er dit drikkevand sikkert? Sådan kan du finde ud af det
- Bygger du på månen og Mars? Du skal bruge udenjordisk cement til det
- Hvorfor forsinkes rumskibets opsendelser så ofte?
- Sol- og vindkraft kan afbøde konflikten i det nordøstlige Afrika
- Ny thalattosaur-art opdaget i det sydøstlige Alaska
- Hvad betyder en frekvens på 15Hz?


