Hvilke oplysninger gives med en molekylær formel?
* De tilstedeværende typer atomer: Det viser de elementer, der udgør molekylet ved hjælp af deres kemiske symboler.
* Antallet af hver type atom: Det bruger underskrifter efter hvert elementsymbol til at indikere antallet af atomer i dette element i molekylet. For eksempel angiver H₂O to hydrogenatomer og et iltatom.
* Det samlede antal atomer i molekylet: Du kan beregne dette ved at opsummere underskrifterne for alle elementerne.
En molekylær formel giver imidlertid ikke følgende oplysninger:
* Arrangementet af atomer (struktur): Det fortæller dig ikke, hvordan atomerne er forbundet til hinanden i molekylet.
* Molekylets form: Det indikerer ikke den tredimensionelle form af molekylet.
* de tilstedeværende obligationer: Det fortæller dig ikke, om obligationerne er enkelt-, dobbelt- eller tredobbelt obligationer.
For denne yderligere information har du brug for en strukturel formel eller en mere detaljeret repræsentation som en Lewis -struktur.
Eksempler:
* h₂o (vand): Denne formel fortæller os, at vand indeholder to hydrogenatomer og et iltatom.
* c₆h₁₂o₆ (glukose): Denne formel indikerer, at glukose har seks carbonatomer, tolv hydrogenatomer og seks iltatomer.
Generelt giver en molekylær formel dig en grundlæggende forståelse af sammensætningen af et molekyle. Det er et udgangspunkt for at forstå molekylets egenskaber, men det giver ikke det komplette billede.
 Varme artikler
Varme artikler
-
 Oprydning af olieudslipOlie i vand. Kredit:Stock billede, via Carnegie Mellon University, Institut for Kemiteknik Efter tusindvis af liter olie hældt ud i Stillehavet efter udslippet den 2. oktober, agenturer og frivill
Oprydning af olieudslipOlie i vand. Kredit:Stock billede, via Carnegie Mellon University, Institut for Kemiteknik Efter tusindvis af liter olie hældt ud i Stillehavet efter udslippet den 2. oktober, agenturer og frivill -
 Hvor skadelige er nano-kobber og svampedræbende kombinationer i vandvejene?Feltprøveindsats, hvor intakte bentiske samfundskerner blev indsamlet. Kredit:Kay Ho En nyligt offentliggjort artikel i Miljøtoksikologi og kemi , Virkninger af mikroniseret og nano-kobberazol p
Hvor skadelige er nano-kobber og svampedræbende kombinationer i vandvejene?Feltprøveindsats, hvor intakte bentiske samfundskerner blev indsamlet. Kredit:Kay Ho En nyligt offentliggjort artikel i Miljøtoksikologi og kemi , Virkninger af mikroniseret og nano-kobberazol p -
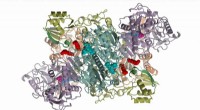 Molekylært maskineri, der fremstiller potent antibiotika, afsløret efter årtiers forskning3D-strukturen af McbBCD, et enzym (protein), der laver det potente antibiotikum mikrocin B17 fra et mindre protein kendt som et peptid, som afsløret ved røntgenkrystallografi. De røde kugler viser k
Molekylært maskineri, der fremstiller potent antibiotika, afsløret efter årtiers forskning3D-strukturen af McbBCD, et enzym (protein), der laver det potente antibiotikum mikrocin B17 fra et mindre protein kendt som et peptid, som afsløret ved røntgenkrystallografi. De røde kugler viser k -
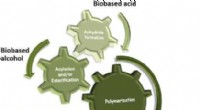 Økonomisk syntese af polyacrylater og polymethacrylater fra biobaserede materialerKredit:Angewandte Chemie På trods af industriens bedste indsats for at arbejde hen imod bæredygtighed, de fleste plastik (eller polymerer) er stadig fremstillet ved hjælp af ikke-fornybare fossile
Økonomisk syntese af polyacrylater og polymethacrylater fra biobaserede materialerKredit:Angewandte Chemie På trods af industriens bedste indsats for at arbejde hen imod bæredygtighed, de fleste plastik (eller polymerer) er stadig fremstillet ved hjælp af ikke-fornybare fossile
- Overlevelsesstrategi:Hvordan et enzym hjælper bakterier med at komme sig efter udsættelse for anti…
- Glas har nu smart potentiale
- New Zealand -brande forventes at brænde i flere uger
- Hvad er molekyleformen for natriumbicarbonat?
- Forfædre i Chaco Canyon dyrkede sandsynligvis deres egen mad
- Hvad er strukturen af bindinger i tetrodotoxin?


