Antagelse om kinetisk teoras gas?
Antagelser om den kinetiske teori om gasser:
Den kinetiske teori om gasser er en model, der forklarer gassens opførsel baseret på bevægelsen af deres konstituerende partikler. Det er afhængig af flere centrale antagelser:
1. Gasser er sammensat af et stort antal partikler (molekyler eller atomer) i konstant tilfældig bevægelse.
- Disse partikler bevæger sig konstant og kolliderer med hinanden og væggene i deres beholder.
- Denne konstante bevægelse er kilden til det tryk, der udøves af gassen.
2. Partiklernes volumen er ubetydelig sammenlignet med beholderens volumen.
- Dette betyder, at det rum, som partiklerne besætter, er ubetydelig sammenlignet med det samlede rum, de besætter.
- Dette giver os mulighed for at behandle partiklerne som punktmasser.
3. Partiklerne udøver ingen kræfter på hinanden undtagen under kollisioner.
- Dette indebærer, at partiklerne ikke tiltrækkes eller afvises af hinanden undtagen korte øjeblikke under kollisioner.
- Denne antagelse er gyldig for ideelle gasser.
4. Kollisioner mellem partikler og beholdervæggene er perfekt elastiske.
- Dette betyder, at ingen energi går tabt under kollisioner.
- Partiklernes kinetiske energi bevares.
5. Partiklernes gennemsnitlige kinetiske energi er proportional med gasens absolutte temperatur.
- Dette indebærer, at når temperaturen på gassen øges, øges den gennemsnitlige kinetiske energi for partiklerne.
- Dette forhold forklarer, hvorfor gasser udvides, når de opvarmes.
Vigtige noter:
* ideel gas: Den kinetiske teori om gasser beskriver opførslen af en ideel gas , som er et teoretisk koncept, der antager, at gaspartiklerne ikke har nogen volumen og ingen intermolekylære kræfter.
* Ægte gasser: Ægte gasser afviger fra ideel opførsel ved høje tryk og lave temperaturer. Dette skyldes, at antagelserne om ubetydelig partikelvolumen og ingen intermolekylære kræfter bliver mindre gyldige under disse forhold.
Disse antagelser danner grundlaget for den kinetiske teori om gasser, som giver os mulighed for at forstå og forudsige adfærd af gasser under forskellige forhold. Det er et kraftfuldt værktøj inden for termodynamik og andre videnskabsområder.
 Varme artikler
Varme artikler
-
 Forskning afslører en ny måde at fremstille chirale katalysatorer påHænder er et simpelt eksempel på chirale objekter - spejlbilleder, men ikke identiske. Kredit:University of Southampton Forskere ved University of Southampton har opdaget en ny måde at skabe en hå
Forskning afslører en ny måde at fremstille chirale katalysatorer påHænder er et simpelt eksempel på chirale objekter - spejlbilleder, men ikke identiske. Kredit:University of Southampton Forskere ved University of Southampton har opdaget en ny måde at skabe en hå -
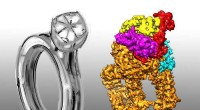 Team rapporterer diamantringarkitektur af et proteinkompleksNuA4 cryo-EM-strukturen ligner en diamantring. Kredit:USTC NuA4/Tip60, et kompleks med diamantringarkitektur, er påkrævet for lovgivnings- og reparationsprocesser. Prof. CAI Gang og Prof. Jacques
Team rapporterer diamantringarkitektur af et proteinkompleksNuA4 cryo-EM-strukturen ligner en diamantring. Kredit:USTC NuA4/Tip60, et kompleks med diamantringarkitektur, er påkrævet for lovgivnings- og reparationsprocesser. Prof. CAI Gang og Prof. Jacques -
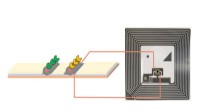 Kemikere udvikler en trådløs elektronisk lateral flow-analysetest til biosensingI denne laterale flowanalyse har papiret, der transporterer opløsningen (til venstre), kontrol- og testlinjer, der kan tilsluttes parallelt med det integrerede kredsløb af en RFID-enhed til trådløs de
Kemikere udvikler en trådløs elektronisk lateral flow-analysetest til biosensingI denne laterale flowanalyse har papiret, der transporterer opløsningen (til venstre), kontrol- og testlinjer, der kan tilsluttes parallelt med det integrerede kredsløb af en RFID-enhed til trådløs de -
 Forskere udvikler Venus fluefanger bio-sensorer for at fange forurenende stofferForskningen præsenteres som et hot paper og er også udvalgt som tidsskriftets forsideillustration. Kredit:Wiley Forskere fra Trinity har skabt en række nye biologiske sensorer ved kemisk at ombygg
Forskere udvikler Venus fluefanger bio-sensorer for at fange forurenende stofferForskningen præsenteres som et hot paper og er også udvalgt som tidsskriftets forsideillustration. Kredit:Wiley Forskere fra Trinity har skabt en række nye biologiske sensorer ved kemisk at ombygg
- Hvor mange jord måneder tager det for Mars at kredse solen?
- Forskere sporer, hvordan sporer bryder ud af hviletilstand
- Hvor gamle er de indvendige sletter?
- Om for mange år siden tror forskere, at universet først begyndte at danne?
- Hvad er densiteten af 1 molært natriumhydroxid i gram pr. Ml?
- Hvilke fly har et kontinuerligt lys om natten?


