Hvorfor produceres to isomerer i nitrering af phenol?
1. Hydroxylgruppens rolle:
* elektron-donerende natur: Hydroxylgruppen er en stærk elektron-donerende gruppe. Det øger elektrondensiteten ved ortho- og para -positionerne i benzenringen på grund af resonans.
* instruktionseffekt: Denne øgede elektrondensitet gør ortho- og para -positionerne mere modtagelige for elektrofilt angreb.
2. Nitreringsmekanismen:
* Elektrofil: Nitroniumionen (NO2+) fungerer som elektrofilen i reaktionen.
* angreb: Nitroniumionen angriber benzenringen ved ortho- eller para -positionerne, hvor elektrondensiteten er højere.
* mellemliggende: En carbocation -mellemprodukt dannes, som stabiliseres af resonans.
* deprotonation: En proton fjernes fra carbocation, regenererer den aromatiske ring og danner nitrophenolproduktet.
3. Hvorfor ikke meta?
Meta-positionen er mindre elektronrig på grund af den deaktiverende virkning af den positive ladning på ilt fra hydroxylgruppen. Dette gør meta -positionen mindre modtagelig for elektrofil angreb.
4. Sterisk hindring:
Selvom ortho -positionen foretrækkes på grund af elektrondensitet, kan den sterisk hindres. Den voluminøse Nitro -gruppe kan opleve en vis sterisk frastødning fra hydroxylgruppen. Dette kan bidrage til dannelsen af para-nitrophenol som det vigtigste produkt i nogle tilfælde.
I resumé producerer nitrationen af phenol to isomerer, ortho og para, på grund af den instruerende virkning af hydroxylgruppen, der favoriserer ortho- og para -positioner til elektrofilt angreb. Meta -positionen er mindre reaktiv på grund af den deaktiverende virkning af hydroxylgruppen.
 Varme artikler
Varme artikler
-
 Designede molekyler fjerner selektivt uønskede ioner fra komplekse løsninger til energiproduktionSpecifikke ioner kan fanges ved hjælp af designede molekylære chelatorer lige fra foldamerer til chlorid, tetraurinstofchelater til sulfat, fastspændte calixpyrroler til lithiumnitrat, og calixcrowns
Designede molekyler fjerner selektivt uønskede ioner fra komplekse løsninger til energiproduktionSpecifikke ioner kan fanges ved hjælp af designede molekylære chelatorer lige fra foldamerer til chlorid, tetraurinstofchelater til sulfat, fastspændte calixpyrroler til lithiumnitrat, og calixcrowns -
 Kryo-EM-billeder i høj opløsning fra Afrika baner vejen for skræddersyede nitrilaser til industri…Ved at maskere en enkelt spiralformet drejning og behandle dette som en enkelt partikel, forskerne var i stand til at forbedre opløsningen væsentligt. Kredit:Diamond lyskilde Et team fra Cape Town
Kryo-EM-billeder i høj opløsning fra Afrika baner vejen for skræddersyede nitrilaser til industri…Ved at maskere en enkelt spiralformet drejning og behandle dette som en enkelt partikel, forskerne var i stand til at forbedre opløsningen væsentligt. Kredit:Diamond lyskilde Et team fra Cape Town -
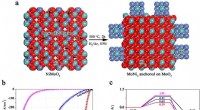 Ny metode til syntese af molekylært hydrogen sætter benchmark for platinfri elektrokatalysatorerFigur. a) Syntetisk skema af MoNi4 elektrokatalysator understøttet af MoO2 kuboiderne på nikkelskum; b) polarisationskurver for MoNi4 elektrokatalysatoren understøttet af MoO2 kuboiderne, rene Ni nano
Ny metode til syntese af molekylært hydrogen sætter benchmark for platinfri elektrokatalysatorerFigur. a) Syntetisk skema af MoNi4 elektrokatalysator understøttet af MoO2 kuboiderne på nikkelskum; b) polarisationskurver for MoNi4 elektrokatalysatoren understøttet af MoO2 kuboiderne, rene Ni nano -
 Video:Kører din brændselscellebil... på benzin?Kredit:The American Chemical Society Brintbrændselscellebiler virker som en fantastisk, lavemissionskørselsløsning:ilt og brint ind, intet andet end vanddamp ud. Men det brint skal komme fra et st
Video:Kører din brændselscellebil... på benzin?Kredit:The American Chemical Society Brintbrændselscellebiler virker som en fantastisk, lavemissionskørselsløsning:ilt og brint ind, intet andet end vanddamp ud. Men det brint skal komme fra et st
- Hvordan hjælper formen på rodhårcelle med at gøre sit job?
- Styring af krystalstørrelsen af organiske halvledere
- Navngiv fire klastiske sedimentære klipper og forklar, hvordan disse form er?
- Hvor udfører forskere deres arbejde?
- Hvordan kan lamaer hjælpe med at besejre biologiske våben?
- Forskere udvikler jordnødder, der er resistente over for aflatoksin


