Kryo-EM-billeder i høj opløsning fra Afrika baner vejen for skræddersyede nitrilaser til industrien
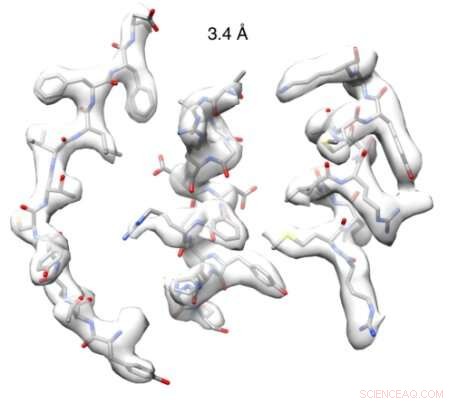
Ved at maskere en enkelt spiralformet drejning og behandle dette som en enkelt partikel, forskerne var i stand til at forbedre opløsningen væsentligt. Kredit:Diamond lyskilde
Et team fra Cape Town har for nylig offentliggjort det første højopløselige kryo-elektronmikroskopi (EM) -papir, der stammer fra Afrika. Som beskrevet i Naturkommunikationsbiologi , teamet løste strukturen af et nitrilasesenzym til en atomopløsning tæt og brugte strukturel indsigt til at designe et mutantenzym, der kunne finjusteres til anvendelser inden for bioteknologi. Dette arbejde blev muliggjort gennem et adgangsprogram finansieret af Synchrotron Techniques for African Research and Technology -projektet, et samarbejdstilskud, der søger at opbygge partnerskaber mellem verdens førende forskere i Afrika og Storbritannien, der arbejder sammen om forskning ved hjælp af synkrotronvidenskab.
Nitrilaser er en fascinerende klasse af planteenzymer, der er væsentlige aktører i syntesen af en lang række vigtige kemikalier. Disse enzymer har typisk specificitet for en lille række substrater, alligevel har de et stort bioteknologisk potentiale. Et team af forskere fra University of Cape Town satte sig for at realisere dette potentiale ved at undersøge strukturen af enzymerne ved hjælp af cryo-EM på elektron Bio-imaging Center (eBIC).
Efter at have lykkes med at opnå strukturel information af høj kvalitet, holdet opnåede et billede tæt på atomopløsning (3,4 Å) af en nitrilase afledt af kålfamilien. Ved hjælp af denne struktur, holdet designede semi-rationelt en ny mutant nitrilase, der virkede på substrater, der ikke katalyseres af andre naturligt forekommende nitrilaser.
Teamet håber, at de kan komme videre til at lave 'designer' nitrilaser til ethvert substrat, som industrien har brug for - uanset om det er lægemidler, fine kemikalier eller endda mad. Mere arbejde på eBIC er planlagt for at fortsætte denne frugtbare undersøgelse.
Spiralformede vendinger
Nitrilaser er en klasse af enzymer, der bruges til at producere carboxylsyrer, ammoniak og amider til storskala syntese af medicin og industrielt vigtige kemikalier. Et team af forskere fra University of Cape Town var fascineret af disse enzymer og ønskede at studere, hvordan de udviklede sig og korrelere deres struktur og funktion.
Gruppen sammenlignede oprindeligt to forskellige nitrilaser fra Arabidopsis thaliana (medlem af kålfamilien) og så, at man havde en bred vifte af underlag, men den anden var meget mere specifik for kun et lille antal substrater. De udførte en række mutationer til enzymernes bindingslomme og fandt ud af, at skift af en enkelt aminosyre ændrede nitrilasernes substratpræference. Med denne pirrende viden, gruppen besluttede at indhente detaljerede strukturelle oplysninger for at afsløre, hvordan nitrilaser vælger deres substrater.
Dr. Jeremy Woodward, Lektor i medicinsk biokemi ved University of Cape Town og hovedundersøger i undersøgelsen forklarede sin gruppes motiver,
"For at prøve at finde ud af, hvad der foregik, tog vi billeder af alle enzymerne ved hjælp af lavopløselig kryo-EM ved University of Cape Town og fandt ud af, at de dannede filamenter, og at tætheden af deres spiralformede twist var korreleret med substratstørrelse. Faktisk, aminosyren, vi opdagede, var placeret ved en grænseflade mellem to spiralformede underenheder. Vi har observeret denne sammenhæng med et stort antal nitrilaseenzymer, men kunne ikke forklare, hvad der skete på molekylært niveau, før vi for nylig besøgte eBIC på Diamond Light Source. "
Tæt på atomstruktur
Holdet havde tidligere brugt negativ farvning elektronmikroskopi (EM), der er begrænset til en opløsning på 20 Å, og er ikke høj nok til at se atomdetaljer i strukturen. Derudover tidligere arbejde fra andre laboratorier havde vist, at nitrilaser ikke kan krystalliseres, så cryo-EM var deres eneste mulighed.
"Dette var den eneste metode, der kunne bruges til at besvare de spørgsmål, de havde, "forklarede Dr. Adriana Klyszejko, postdoktoral forskningsassistent på eBIC, der hjalp med undersøgelsen. "På Diamond, det, vi har skabt, er en integreret indsats for vores brugerfællesskab, hvor de kan skubbe deres forskning videre. "
På eBIC, holdet opnåede en struktur med en opløsning på 3,4 Å. Dr. Woodward, uddybet:
"Den høje kvalitet af de data, vi opnåede, gjorde det muligt for os at visualisere strukturen af et intakt nitrilase-spiralformet filament i nærheden af atomopløsning for første gang. Vi observerede en sløjfe, holdt på plads af den aminosyre, vi opdagede, der begrænser den maksimale størrelse af bundne substrater og skifter med spiralformet twist. "
START -tilskuddet
Arbejdet blev muliggjort med et tilskud fra Synchrotron Techniques for African Research and Technology (START); et initiativ, der blev oprettet i marts 2019 for at opbygge partnerskaber mellem forskere i Afrika og Storbritannien. START finansieres af et tilskud på 3,7 mio. £ fra UKRI's Science and Technology Facilities Council (STFC) fra Global Challenges Research Fund (GCRF). STFC tildelte midlerne fra GCRF, en 5-årig £ 1,5 mia. fond, der er en vigtig komponent i leveringen af den britiske bistandsstrategi, at sikre, at britisk forskning indtager en ledende rolle i håndteringen af de problemer, udviklingslandene står over for gennem forskning og innovation.
Motivationen til START kommer fra de samfundsmæssige udfordringer, de afrikanske samfund står over for; for eksempel, 600 millioner mennesker (70%) i Afrika syd for Sahara lever uden elektricitet, og en pålidelig elforsyning er et af de mest kraftfulde værktøjer til at løfte mennesker ud af fattigdom og afslutte deres afhængighed af bistand. START -forskere vil undersøge energimaterialer, herunder solcellestrukturer, katalysatorer og batterier. Udviklingen af sundhedsydelser i Afrika hæmmes af en mangel på grundlæggende forståelse af årsagen til sygdomme som malaria eller hiv. Strukturbiologi giver en hidtil uset indsigt i mekanismerne bag sådanne sygdomme.
Samt at give forskere fra Sydafrika adgang til faciliteterne i verdensklasse på eBIC, tilskuddet støttede også postdoktor, Dr. Andani Mulelu, der var undersøgelsens hovedforsker. "Dette arbejde havde ikke været muligt uden dette, fordi udstyret, støtte og infrastruktur, der er nødvendig for at gennemføre dette eksperiment, er ikke tilgængelig i Afrika, "forklarede Dr. Woodward.
Dr. Gwyndaf Evans, Hovedstråleforsker på Diamond's VMXm beamline, og biovidenskabelig hovedundersøger for START -projektets kommentarer:
"START -initiativet sigter mod, blandt andet, at hjælpe med at opbygge ekspertise og kapacitet til strukturbiologi i Afrika. Oprindeligt lægger vi vægt på at lette adgangen til Diamonds strukturbiologiske faciliteter, selvom der fokuseres på kurser i Sydafrika og lokalt her på Diamond. Det ultimative mål er at demonstrere for afrikanske finansieringsorganer kraften og fordelene ved strukturbiologi i håndteringen af afrikanske problemer inden for menneskers sundhed og landbrug for at gøre strukturbiologi til en bæredygtig aktivitet på kontinentet. At se eksperter som Jeremy Woodward opnå en fast stilling i Sydafrika lover godt for fremtiden og går på en eller anden måde for at opbygge denne bæredygtighed. "
Designer nitrilaser
Ved hjælp af den indsigt, der er opnået fra cryo-EM-strukturen i høj opløsning, holdet screenede over 5, 000 mutanter til at designe et nyt enzym med et ændret spiralformet twist, der virker på et nyt sæt substrater, der ikke katalyseres af andre plantens nitrilaser. Dette blev udført ved at identificere 'hotspot' -aminosyrer til styret udvikling og vælge dem ved at koble overlevelse af bakterier til en vellykket omdannelse af et bibliotek af substrater.
Bygger på dette arbejde, teamet håber at finjustere nitrilaser for at realisere deres fulde bioteknologiske potentiale. "Vi vil gerne komme til det punkt, hvor vi kan producere 'designer' -nitrilaser til ethvert substrat ved at foretage passende ændringer af spiralformet twist og bindingslomme. For at opnå dette, vi vil gerne visualisere en samling af centrale nitrilaser med en række forskellige spiralformede tilstande (og substratspecificiteter) ved højopløselig cryo-EM, "sluttede prof. Woodward.
 Varme artikler
Varme artikler
-
 Forskere producerer højstyrkepuds udelukkende af affaldVed at bruge affaldsstoffer fra forskellige industrier har KTU -forskere støbt gipssten, som er to gange stærkere end normalt. Kredit:KTU Omkring 5 tons fosfogips produceres pr. Ton fosforsyreprod
Forskere producerer højstyrkepuds udelukkende af affaldVed at bruge affaldsstoffer fra forskellige industrier har KTU -forskere støbt gipssten, som er to gange stærkere end normalt. Kredit:KTU Omkring 5 tons fosfogips produceres pr. Ton fosforsyreprod -
 Kemikere syntetiserer en ny katalysator til olie- og gasbehandlingStrukturen af pentanukleære prismatiske metallasilsesquioxaner (kobber og koboltholdig) Kredit:Alexey Bilyachenko Et team af forskere fra Research Institute of Chemistry (RIC) ved RUDN Universit
Kemikere syntetiserer en ny katalysator til olie- og gasbehandlingStrukturen af pentanukleære prismatiske metallasilsesquioxaner (kobber og koboltholdig) Kredit:Alexey Bilyachenko Et team af forskere fra Research Institute of Chemistry (RIC) ved RUDN Universit -
 Forskere udvikler tilgang til vedvarende energi til fremstilling af ammoniakWilliam Schneider. Kredit:University of Notre Dame Forskere ved University of Notre Dame udvikler en tilgang til vedvarende energi til at syntetisere ammoniak, en væsentlig komponent af gødning, d
Forskere udvikler tilgang til vedvarende energi til fremstilling af ammoniakWilliam Schneider. Kredit:University of Notre Dame Forskere ved University of Notre Dame udvikler en tilgang til vedvarende energi til at syntetisere ammoniak, en væsentlig komponent af gødning, d -
 Nyt stål for at fordoble levetiden for oliefeltsrørledningerAlexander Komissarov, en af udviklerne og en NUST MISIS forskningsmedarbejder. Kredit:© Sergey Gnuskov/NUST MISIS Det særlige ved olieudviklingsteknologi i russiske oliefelter har skabt efterspø
Nyt stål for at fordoble levetiden for oliefeltsrørledningerAlexander Komissarov, en af udviklerne og en NUST MISIS forskningsmedarbejder. Kredit:© Sergey Gnuskov/NUST MISIS Det særlige ved olieudviklingsteknologi i russiske oliefelter har skabt efterspø
- Forskere kortlægger strukturen af det centrale kromatin-ombygningskompleks
- Nye værktøjer kan give jernbeklædt vished om, at computerfejl hører fortiden til
- Forskere observerer dannelsen af en magnetar 6,5 milliarder lysår væk
- Forskere opdager beviser for de seneste vandstrømme på Mars
- Passiv rewilding kan hurtigt udvide britisk skov uden omkostninger
- Hvordan (og hvorfor) at forblive optimistisk, når det føles som om miljøet falder fra hinanden


