Hvorfor er blychlorid et kraftfuldt oxidationsmiddel?
* bly's oxidationstilstand: Bly i PBCL₂ har en oxidationstilstand på +2. Mens bly kan have højere oxidationstilstande (som +4 i blybioxid, PBO₂), er +2 dens mere almindelige og stabile tilstand.
* Elektrokemisk potentiale: Standardreduktionspotentialet for Pb²⁺/Pb -parret er -0,13 V. Dette indikerer, at føringsioner ikke er særlig stærke oxidatorer.
* blychlorides stabilitet: Blychlorid er relativt stabil og gennemgår ikke let oxidationsreaktioner.
I stedet for at være et kraftfuldt oxidationsmiddel, er det mere sandsynligt, at chlorid fungerer som et reducerende middel i visse reaktioner. Dette skyldes, at bly kan oxideres yderligere til en højere oxidationstilstand.
Eksempel: I nærvær af et stærkt oxidationsmiddel, som chlorgas (CL₂), kan blychlorid reagere på dannelse af bly -tetrachlorid (PBCL₄), hvor bly er i +4 oxidationstilstand.
pbcl₂ + cl₂ → pbcl₄
Nøglepunkt: Den oxiderende styrke af en forbindelse afhænger af dens evne til at vinde elektroner. Blychlorides elektrokemiske potentiale og dets tendens til at blive oxideret i visse reaktioner antyder, at det ikke er et kraftfuldt oxidationsmiddel, men snarere et svagt eller endda et reducerende middel afhængigt af reaktionsbetingelserne.
Sidste artikelHvad er konverteringen fra mol til atomer?
Næste artikelNår et stof smelter temperaturen på stoffet?
 Varme artikler
Varme artikler
-
 Ingeniører laver en simpel test, der kan måle stresshormoner i sved, blod, urin eller spytUniversity of Cincinnati forskningsassistent Shima Dalirirad undersøger en maskine, der udskriver teststrimler i UCs Nanoelectronics Laboratory. Kredit:Andrew Higley/UC Creative Services Stress ka
Ingeniører laver en simpel test, der kan måle stresshormoner i sved, blod, urin eller spytUniversity of Cincinnati forskningsassistent Shima Dalirirad undersøger en maskine, der udskriver teststrimler i UCs Nanoelectronics Laboratory. Kredit:Andrew Higley/UC Creative Services Stress ka -
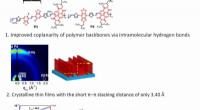 Organisk elektronik:Forskere udvikler en højtydende unipolær n-type tyndfilmstransistorRationelt design af elektrontransporterende organiske halvledende polymerer og deres tyndfilmsanalyse og transistorpræstationer. Kredit: Journal of the American Chemical Society Forskere ved Toky
Organisk elektronik:Forskere udvikler en højtydende unipolær n-type tyndfilmstransistorRationelt design af elektrontransporterende organiske halvledende polymerer og deres tyndfilmsanalyse og transistorpræstationer. Kredit: Journal of the American Chemical Society Forskere ved Toky -
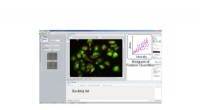 Forskere udvikler cellesugende teknologiPrikker i Histogram Feature Quantities svarer til hver celle. Vælg og klik på prikkerne på histogrammet for at bestemme, hvilke celler der skal suges. T baseret på de forudindstillede funktionsmængder
Forskere udvikler cellesugende teknologiPrikker i Histogram Feature Quantities svarer til hver celle. Vælg og klik på prikkerne på histogrammet for at bestemme, hvilke celler der skal suges. T baseret på de forudindstillede funktionsmængder -
 Salt tager et hurtigt skridt, før det falder ud af vandetI et fund med konsekvenser for emner, herunder klimamodeller og lægemiddelproduktion, beregningsmæssig forskning fra Princeton University har beskrevet et yderligere trin i udfældningen af saltkryst
Salt tager et hurtigt skridt, før det falder ud af vandetI et fund med konsekvenser for emner, herunder klimamodeller og lægemiddelproduktion, beregningsmæssig forskning fra Princeton University har beskrevet et yderligere trin i udfældningen af saltkryst
- Hvordan tranebærmoser virker
- Hvordan forekommer celledeling i prokaryoter?
- Navngiv to metoder, der bruges af opdrættere til at øge mutationshastigheden?
- Lordstown Motors begynder at fremstille elektriske lastbiler på fabrikken i Ohio
- Hvorfor hedder Ignleous Rock en mor rock?
- Litauen erklærer nødsituation, da tørken rammer landmændene


