Hvordan påvirker strukturen af et vandmolekyle dens egenskaber?
1. Bøjet form og polaritet:
* struktur: Et vandmolekyle består af to hydrogenatomer bundet til et iltatom. Molekylet har en bøjet form (som en V) på grund af de ensomme par elektroner på iltatomet.
* Polaritet: Oxygenatomet er mere elektronegativt end hydrogenatomerne, hvilket betyder, at det tiltrækker elektroner stærkere. Dette skaber en delvis negativ ladning På ilt og delvis positive afgifter På hydrogenatomerne. Denne ujævne fordeling af ladning gør vandmolekylet polar .
2. Hydrogenbinding:
* dannelse: Den polære karakter af vand giver det mulighed for at danne hydrogenbindinger . Den positive brint ende af et vandmolekyle tiltrækker den negative ilt ende af en anden.
* stærkere end andre intermolekylære kræfter: Disse bindinger er relativt stærke og skaber et sammenhængende netværk af vandmolekyler.
egenskaber ved vand:
* Højt kogepunkt: De stærke hydrogenbindinger kræver betydelig energi til at bryde, hvilket fører til et højt kogepunkt.
* højt smeltepunkt: Tilsvarende bidrager brintbindinger til et højt smeltepunkt.
* Høj overfladespænding: De sammenhængende kræfter på grund af brintbindinger skaber en stærk overfladespænding, hvilket gør det muligt for vand at danne dråber og understøtte lette genstande.
* Fremragende opløsningsmiddel: Polariteten af vand giver det mulighed for at opløse mange polære og ioniske forbindelser.
* Høj varmekapacitet: Vand kan absorbere en stor mængde varme uden at ændre dens temperatur væsentligt. Dette hjælper med at regulere temperaturer i levende organismer og på jorden.
Kortfattet:
Den bøjede form og polaritet af vandmolekylet giver det mulighed for at danne stærke brintbindinger. Disse bindinger giver på sin side vand sine unikke egenskaber, herunder højt kogepunkt, højt smeltepunkt, høj overfladespænding, fremragende opløsningsmiddelkapaciteter og højvarmekapacitet. Disse egenskaber gør vand afgørende for livet, som vi kender det.
 Varme artikler
Varme artikler
-
 Kombination af mikrobielle og kemiske fingeraftryk til retsmedicinske applikationerUC San Diego-forskere udviklede et open source-værktøj kaldet ili til at kortlægge data om bakterier og molekyler på en 3D-model af et kontor. Kredit:University of California - San Diego Forskere
Kombination af mikrobielle og kemiske fingeraftryk til retsmedicinske applikationerUC San Diego-forskere udviklede et open source-værktøj kaldet ili til at kortlægge data om bakterier og molekyler på en 3D-model af et kontor. Kredit:University of California - San Diego Forskere -
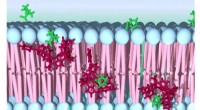 Antænde den syntetiske transport af aminosyrer i levende cellerKredit:Institut for Forskning i Biomedicin - IRB Transporten af aminosyrer og andre molekyler over cellens membran spiller en afgørende rolle i metabolismen af celler og, derfor, i menneskers
Antænde den syntetiske transport af aminosyrer i levende cellerKredit:Institut for Forskning i Biomedicin - IRB Transporten af aminosyrer og andre molekyler over cellens membran spiller en afgørende rolle i metabolismen af celler og, derfor, i menneskers -
 Forskere udvikler et fast materiale med mobile partikler, der reagerer på miljøetVed høje temperaturer (venstre) bevæger partikler sig frit i dråberne og giver materialet en rubinrød farve; de agglomererer ved lavere temperaturer (til højre) og ændrer materialets farve til gråviol
Forskere udvikler et fast materiale med mobile partikler, der reagerer på miljøetVed høje temperaturer (venstre) bevæger partikler sig frit i dråberne og giver materialet en rubinrød farve; de agglomererer ved lavere temperaturer (til højre) og ændrer materialets farve til gråviol -
 Super lette dæmpere til lave tonerEmpa -forskere udviklede kirale fononiske krystaller og byggede en funktionel model, hvorpå vibrationsmålinger nu udføres. Kredit:Empa Et hold af Empa akustiske forskere har bygget makroskopiske k
Super lette dæmpere til lave tonerEmpa -forskere udviklede kirale fononiske krystaller og byggede en funktionel model, hvorpå vibrationsmålinger nu udføres. Kredit:Empa Et hold af Empa akustiske forskere har bygget makroskopiske k
- Udforsker fremmedhed og det oprindelige univers
- Partikelrobot fungerer som en klynge af simple enheder
- Normalt en isolator, diamant bliver en metallisk leder, når den udsættes for store belastninger i …
- Sådan læses en Manometer
- Hvad er Jordens alder i Charles Theory?
- Hvad sker der med energien i olien, når du bruger den til at opvarme dit hus?


