Hvad er virkningen af tilsætning af en katalysator på hastighedskemisk reaktion?
Hvad er en katalysator?
En katalysator er et stof, der fremskynder en kemisk reaktion uden at blive konsumeret i processen. Det gør dette ved at tilvejebringe en alternativ reaktionsvej med en lavere aktiveringsenergi.
Hvordan katalysatorer fungerer:
* Nedre aktiveringsenergi: Katalysatorer sænker aktiveringsenergien for en reaktion. Dette er den mindste mængde energi, som reaktantmolekyler har brug for at kollidere med hinanden effektivt og danne produkter. Ved at sænke aktiveringsenergien har flere molekyler nok energi til at reagere, hvilket fører til en hurtigere reaktionshastighed.
* Tilvejebringelse af en alternativ vej: Katalysatorer tilbyder en anden rute for reaktionen at fortsætte, ofte involverer mellemtrin, der er lettere at overvinde end den originale vej.
* Forøgelse af hyppigheden af effektive kollisioner: Katalysatorer kan også øge hyppigheden af effektive kollisioner mellem reaktantmolekyler ved at bringe dem tættere sammen eller orientere dem på en måde, der fremmer reaktion.
Vigtige noter:
* katalysatorer forbruges ikke: Katalysatorer er ikke reaktanter og bruges ikke op under reaktionen. De kan deltage i reaktionsmekanismen, men regenereres til sidst.
* katalysatorer ændrer ikke ligevægten: Katalysatorer påvirker kun hastigheden for en reaktion, ikke den endelige ligevægtsposition. Ligevægtskonstanten (K) forbliver den samme.
* specifikke katalysatorer til specifikke reaktioner: Forskellige reaktioner kræver forskellige katalysatorer, da mekanismen og aktiveringsenergibarrierer varierer.
Eksempler på katalysatorer:
* enzymer: Biologiske katalysatorer, der fremskynder biokemiske reaktioner i levende organismer.
* Metaller: Nogle metaller, som platin og palladium, fungerer som katalysatorer i forskellige industrielle processer.
* syrer: Syrer kan fungere som katalysatorer for visse reaktioner, som esterificering.
Konklusion: Katalysatorer er vigtige for mange kemiske reaktioner, der fremskynder deres satser uden at blive konsumeret i processen. De giver alternative veje med lavere aktiveringsenergier, hvilket fører til hurtigere reaktionshastigheder.
 Varme artikler
Varme artikler
-
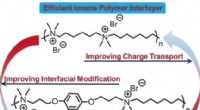 Fullerener bygger bro over ledende kløft i organisk fotovoltaikKredit:Wiley Organisk solceller har opnået bemærkelsesværdigt høje effektiviteter, men at finde optimale kombinationer af materialer til højtydende organiske solceller, som også er økonomisk konku
Fullerener bygger bro over ledende kløft i organisk fotovoltaikKredit:Wiley Organisk solceller har opnået bemærkelsesværdigt høje effektiviteter, men at finde optimale kombinationer af materialer til højtydende organiske solceller, som også er økonomisk konku -
 Selvkomprimerende beton bliver mere bæredygtig takket være at bruge granitresterEn UCO-undersøgelse beviser muligheden for at erstatte op til 40% af konventionelle tilslag af selvkomprimerende mørtel med granitslam, dermed reducere byggesektorens miljøbelastning. Kredit:Universit
Selvkomprimerende beton bliver mere bæredygtig takket være at bruge granitresterEn UCO-undersøgelse beviser muligheden for at erstatte op til 40% af konventionelle tilslag af selvkomprimerende mørtel med granitslam, dermed reducere byggesektorens miljøbelastning. Kredit:Universit -
 Lys kan bruges til at kontrollere genfunktionenOptogenetics anvender metoder, hvor lys kan bruges til at styre cellulære funktioner. Kredit:Jari Rossi Lys kan bruges som en nøjagtig metode til at kontrollere genekspression, viser banebrydende
Lys kan bruges til at kontrollere genfunktionenOptogenetics anvender metoder, hvor lys kan bruges til at styre cellulære funktioner. Kredit:Jari Rossi Lys kan bruges som en nøjagtig metode til at kontrollere genekspression, viser banebrydende -
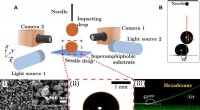 Løft af en siddende dråbe fra en superamfifob overflade ved hjælp af en stødende dråbeEksperimentel tilgang og det fastsiddende fald. (A) Skitse af den eksperimentelle opsætning for binær dråbepåvirkning på superamfifobe overflader. Nålen er fikseret for at indstille stødhøjden i Z-ret
Løft af en siddende dråbe fra en superamfifob overflade ved hjælp af en stødende dråbeEksperimentel tilgang og det fastsiddende fald. (A) Skitse af den eksperimentelle opsætning for binær dråbepåvirkning på superamfifobe overflader. Nålen er fikseret for at indstille stødhøjden i Z-ret
- Hvilken energi bidrager mest til klimaændringer?
- Forskere i Kina finder nogle af de ældste eksempler på kraniemodifikation
- Drevet af Kinas frygt, Russerne protesterer på Baikal -aftappningsanlæg
- Hvordan handler planter hurtigt for at bekæmpe infektioner?
- Hvordan påvirker invasive arter biodiversitetsområdet?
- Nyt materiale lover løfte om at skabe mere fleksibel, effektive teknologier


