Hvad tror du, at dens kogepunkt ville være, hvis vandmolekyler var ubehagelige molekyler?
* Hydrogenbinding: Det høje kogepunkt af vand skyldes primært stærke brintbindinger mellem vandmolekyler. Disse bindinger opstår fra vandmolekylets polære karakter, med dets delvist positive hydrogenatomer tiltrukket af de delvist negative iltatomer af nærliggende molekyler.
* ikke -polære interaktioner: Hvis vand var ikke -polært, ville de primære intermolekylære kræfter, der holdt molekylerne sammen, være svage London -spredningskræfter. Disse kræfter er meget svagere end brintbindinger.
* lavere energi til at adskille: Med svagere intermolekylære kræfter ville der kræves mindre energi for at overvinde disse attraktioner og overgang fra væsken til gasfasen. Dette betyder et lavere kogepunkt.
Analoge eksempler:
* methan (CH4): Metan er et ikke -polært molekyle. Dens kogepunkt er -161,5 ° C (-258,7 ° F), markant lavere end vand.
* ethan (C2H6): Et andet ikke -polært molekyle, ethan har et kogepunkt på -88,6 ° C (-127,5 ° F).
Derfor, hvis vandmolekyler var ikke -polære, ville dets kogepunkt sandsynligvis svare til det for metan eller ethan, et eller andet sted i området -100 ° C til -150 ° C (-148 ° F til -238 ° F).
Bemærk: Dette er en tilnærmelse. Det faktiske kogepunkt afhænger af den specifikke karakter af de ikke -polære interaktioner, men det ville uden tvivl være meget lavere end vandets nuværende kogepunkt.
Sidste artikelHvad er tetrazolium farvestof og hvad dens funktion?
Næste artikelHvad er typer atom i 6O2?
 Varme artikler
Varme artikler
-
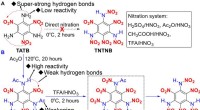 Syntese af TNTNB repræsenterer ny energitop for organiske sprængstofferSyntese af TNTNB.(A) Mislykket nitrering fra TATB til TNTNB ved brug af forskellige nitreringssystemer. (B) Syntese af TNTNB under anvendelse af den foreslåede acylerings-aktiverings-nitreringsstrateg
Syntese af TNTNB repræsenterer ny energitop for organiske sprængstofferSyntese af TNTNB.(A) Mislykket nitrering fra TATB til TNTNB ved brug af forskellige nitreringssystemer. (B) Syntese af TNTNB under anvendelse af den foreslåede acylerings-aktiverings-nitreringsstrateg -
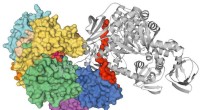 En ny generation af lægemidler mod malariaPKG krystal. Kredit:Canadisk lyskilde Malaria er endemisk for store områder i Afrika, Asien og Sydamerika og dræber årligt mere end 400, 000 mennesker, hvoraf et flertal er børn under 5 år, med hu
En ny generation af lægemidler mod malariaPKG krystal. Kredit:Canadisk lyskilde Malaria er endemisk for store områder i Afrika, Asien og Sydamerika og dræber årligt mere end 400, 000 mennesker, hvoraf et flertal er børn under 5 år, med hu -
 Vellykket syntese af gamma-lactamringe fra kulbrinterSelektiv amideringsreaktion ved anvendelse af nydesignede iridium (Ir) katalysatorer. Rigelig i naturen Kulbrinter bruges som substrater til syntetisering af nitrogenholdig ring, kaldet gamma-laktamer
Vellykket syntese af gamma-lactamringe fra kulbrinterSelektiv amideringsreaktion ved anvendelse af nydesignede iridium (Ir) katalysatorer. Rigelig i naturen Kulbrinter bruges som substrater til syntetisering af nitrogenholdig ring, kaldet gamma-laktamer -
 Krystaløer kan halvere tid og omkostninger ved videnskabelige eksperimenterEn siliciumprøve renses med høj temperatur, i et Omicron VT-AFM/XA multifunktionssystem. Kredit:QUT QUT-forskere har fundet en måde at dyrke krystaløer på, som kan halvere tiden og omkostningerne
Krystaløer kan halvere tid og omkostninger ved videnskabelige eksperimenterEn siliciumprøve renses med høj temperatur, i et Omicron VT-AFM/XA multifunktionssystem. Kredit:QUT QUT-forskere har fundet en måde at dyrke krystaløer på, som kan halvere tiden og omkostningerne
- Sådan Find Partial Pressure
- At bygge et biokemisk laboratorium på en chip
- Hvilken Bright Star kan du finde ved at følge håndtaget af Big Dipper hele vejen til Constellation…
- Det betaler sig at være pessimistisk, viser ny forskning i iværksættere
- Den globale opvarmning kan være det dobbelte af, hvad klimamodeller forudsiger
- Hvor hører koefficienten i den kemiske formel?


