Hvorfor er magnesiumchlorid mgcl2?
* magnesium (mg): Magnesium er et alkalisk jordmetal i gruppe 2 i den periodiske tabel. Det har to valenselektroner (elektroner i dets yderste skal).
* klor (Cl): Chlor er et halogen i gruppe 17 i den periodiske tabel. Det har syv valenselektroner.
ionisk binding:
1. Elektronoverførsel: Magnesium ønsker at miste sine to valenselektroner for at opnå en stabil elektronkonfiguration som Noble Gas Neon. Klor har på den anden side brug for endnu en elektron for at opnå en stabil elektronkonfiguration som den ædle gas -argon.
2. Dannelse af ioner: Magnesium mister to elektroner og bliver en positivt ladet ion (mg²⁺). Hvert kloratom får en elektron og bliver en negativt ladet ion (CL⁻).
3. Elektrostatisk attraktion: De modsatte ladede ioner tiltrækkes af hinanden gennem elektrostatiske kræfter. Denne attraktion resulterer i dannelsen af en ionisk binding.
Formel:
* mg²⁺ (Magnesiumion) har brug for to klorioner (CL⁻) for at afbalancere dens positive ladning.
* Derfor er den kemiske formel for magnesiumchlorid mgcl₂ .
I det væsentlige afspejler formlen MGCL₂ de afbalancerede elektrostatiske kræfter mellem magnesiumkationen (Mg²⁺) og to chloridanioner (CL⁻).
Sidste artikelHvor mange atomer er der i et molekyle af helium?
Næste artikelKan ædle gasser binde til hvert atom?
 Varme artikler
Varme artikler
-
 Aflytning af australske edderkoppers hemmeligheder unikt silkeKurve-spindderkoppen i sin naturlige form med sin unikke hummerpottespind og silke, som nu er blevet afsløret som enestående robust. Kredit:Professor Mark Elgar, University of Melbourne Et interna
Aflytning af australske edderkoppers hemmeligheder unikt silkeKurve-spindderkoppen i sin naturlige form med sin unikke hummerpottespind og silke, som nu er blevet afsløret som enestående robust. Kredit:Professor Mark Elgar, University of Melbourne Et interna -
 Startup skalerer kulstof-nanorørmembraner op for at lave kulstof-nul brændstoffer til mindre end f…Mattershift, en NYC-baseret startup med alumner fra MIT og Yale har opnået et gennembrud i fremstillingen af carbon nanorør (CNT) membraner i stor skala. Startupet udvikler teknologiens evne til at
Startup skalerer kulstof-nanorørmembraner op for at lave kulstof-nul brændstoffer til mindre end f…Mattershift, en NYC-baseret startup med alumner fra MIT og Yale har opnået et gennembrud i fremstillingen af carbon nanorør (CNT) membraner i stor skala. Startupet udvikler teknologiens evne til at -
 Lys på effektivitetstab i organiske solcellerVed hjælp af en kompleks laseropsætning, holdet opdagede, at i modsætning til de seneste rapporter, betydelige ioniseringsenergiforskydninger var nødvendige for at generere ladninger. Kredit:© 2020 KA
Lys på effektivitetstab i organiske solcellerVed hjælp af en kompleks laseropsætning, holdet opdagede, at i modsætning til de seneste rapporter, betydelige ioniseringsenergiforskydninger var nødvendige for at generere ladninger. Kredit:© 2020 KA -
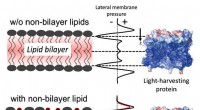 Team opdager en mekanisme, planter bruger til at slå fotosyntesen tilDenne figur viser proteinet, til højre, som ændres fra energiskaber til energidissipator af ikke-dobbeltlagslipid, venstre. Kredit:Washington State University Høst af sollys for at skabe energi er
Team opdager en mekanisme, planter bruger til at slå fotosyntesen tilDenne figur viser proteinet, til højre, som ændres fra energiskaber til energidissipator af ikke-dobbeltlagslipid, venstre. Kredit:Washington State University Høst af sollys for at skabe energi er
- Atomer, der mister elektroner og bliver elektrisk ladet, kaldes?
- Hvad betyder drop zone?
- Hvad er Rubidium lavet af?
- Hvorfor modtager den ydre kant af atmosfæren ved Nordpolen ingen solstråling i december?
- Sådan laver du en dyrecelle ud af slik
- Kromosomnummeret i en ægcellekerne på en plante er 14 Hvad den normale rodepidermal samme plante?


