Kan ædle gasser binde til hvert atom?
Her er hvorfor:
* Fuld valensskaller: Noble gasser har en fuld ydre skal af elektroner, hvilket gør dem ekstremt stabile og ureaktive. Derfor kaldes de "ædle" gasser.
* Begrænset binding: De kan kun binde sig under meget specifikke og ekstreme forhold, såsom:
* Højt tryk: Under højt tryk kan de danne forbindelser som XEPTF6 (Xenon hexafluoroplatinat) og KRF2 (Krypton difluorid).
* plasma: I en plasmatilstand kan de danne ioner og deltage i reaktioner.
* excitation: Når de er begejstrede med energi, kan de midlertidigt danne obligationer.
* Andre elementer: De fleste elementer danner let bindinger på grund af deres ufuldstændige ydre skaller, hvilket gør dem mere reaktive end ædle gasser.
Derfor, selvom det er muligt for ædle gasser at binde under specifikke forhold, binder de sig ikke let med hvert atom. Deres stabilitet og fulde elektronskaller gør dem mindre tilbøjelige til at deltage i kemiske reaktioner sammenlignet med andre elementer.
Sidste artikelHvorfor er magnesiumchlorid mgcl2?
Næste artikelHvad er den krystallinske forbindelse afledt af forskellige planter?
 Varme artikler
Varme artikler
-
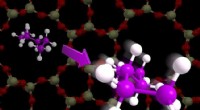 Forskere opdager, hvordan burmolekyler rasler og syngerHexan, et molekyle med seks carbonatomer, vil vælte, spin og vibrere mindre i et nanoporøst bur, men den kan stadig bevæge sig i to dimensioner. Kredit:Catalysis Center for Energy Innovation Et te
Forskere opdager, hvordan burmolekyler rasler og syngerHexan, et molekyle med seks carbonatomer, vil vælte, spin og vibrere mindre i et nanoporøst bur, men den kan stadig bevæge sig i to dimensioner. Kredit:Catalysis Center for Energy Innovation Et te -
 Hemmelighederne bag en uhyggelig fotografisk teknikEt sort-hvidt fotografi behandlet med mordanҫage-processen viser karakteristiske slør aflejret på mørke områder af trykket. Kredit:Tilpasset fra Analytisk kemi 2019, DOI:10.1021/acs.analchem.9b03205
Hemmelighederne bag en uhyggelig fotografisk teknikEt sort-hvidt fotografi behandlet med mordanҫage-processen viser karakteristiske slør aflejret på mørke områder af trykket. Kredit:Tilpasset fra Analytisk kemi 2019, DOI:10.1021/acs.analchem.9b03205 -
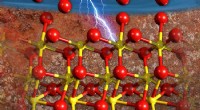 Atomer omarrangeres i elektrolyt og kontrollerer ionstrømmen under hårde forholdGrænsefladen mellem jernrig hæmatit (bund) og vand (øverst) ændres, efterhånden som overfladen bliver elektrisk ladet. Iltatomer (røde) omarrangerer sig på overfladen, udfylde alle steder, hvor der ma
Atomer omarrangeres i elektrolyt og kontrollerer ionstrømmen under hårde forholdGrænsefladen mellem jernrig hæmatit (bund) og vand (øverst) ændres, efterhånden som overfladen bliver elektrisk ladet. Iltatomer (røde) omarrangerer sig på overfladen, udfylde alle steder, hvor der ma -
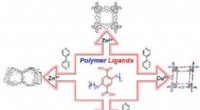 Forbedret stabilitet i nærvær af vand kan hjælpe med at reducere emissioner af drivhusgassery kombinerer forskellige metalatomer (for eksempel zink, Zn, eller kobber, Cu) med de molekylære polymerkæder (eller ligander), videnskabsmænd kan kontrollere den resulterende struktur. Ved at kontrol
Forbedret stabilitet i nærvær af vand kan hjælpe med at reducere emissioner af drivhusgassery kombinerer forskellige metalatomer (for eksempel zink, Zn, eller kobber, Cu) med de molekylære polymerkæder (eller ligander), videnskabsmænd kan kontrollere den resulterende struktur. Ved at kontrol
- Hvorfor universet kan være et hologram
- Hvad er processen alluvial deponering?
- Hvem vandt Nobels fredspris for at finde ud af, at elektroner i atomer forbliver specifikke?
- Hvordan sociale netværkssider kan diskriminere kvinder
- Hvad vil et elektrisk neutralt atom have lige antal?
- Hvad holder molekyler sammen?


