Hvad holder molekyler sammen?
1. Intramolekylære kræfter: Disse kræfter findes * inden for * et molekyle, der holder atomerne sammen for at danne selve molekylet. Den stærkeste af disse kræfter er kemiske bindinger , som kan være af tre hovedtyper:
* kovalente obligationer: Disse bindinger involverer deling af elektroner mellem atomer. Dette er den mest almindelige type binding i organiske molekyler, som vand (H₂O) og methan (CH₄).
* ioniske bindinger: Disse bindinger dannes, når et atom mister et elektron til et andet atom, hvilket skaber modsat ladede ioner, der tiltrækkes af hinanden. Eksempler inkluderer tabel salt (NaCl) og kaliumchlorid (KCL).
* Metalliske obligationer: Disse bindinger forekommer i metaller, hvor elektroner er delokaliserede og frie til at bevæge sig gennem hele metalstrukturen. Dette giver metaller deres karakteristiske egenskaber som ledningsevne og formbarhed.
2. Intermolekylære kræfter: Disse kræfter findes * mellem * molekyler, holder dem sammen og påvirker de fysiske egenskaber ved stoffer som deres smeltepunkt og kogepunkt. De er generelt svagere end intramolekylære kræfter, men spiller stadig en betydelig rolle i bestemmelsen af stoffets opførsel. Nogle almindelige intermolekylære kræfter inkluderer:
* Hydrogenbinding: Dette er en stærk type intermolekylær kraft, der opstår, når et hydrogenatom er bundet til et stærkt elektronegativt atom som ilt, nitrogen eller fluor. Dette skaber et dipolmoment, hvilket fører til stærke attraktioner mellem molekyler. Vand er et godt eksempel på et stof, der udviser hydrogenbinding.
* dipol-dipolinteraktioner: Disse interaktioner forekommer mellem polære molekyler, hvor den ene ende af molekylet har en delvis positiv ladning, og den anden ende har en delvis negativ ladning. Disse delvise afgifter tiltrækker hinanden, hvilket fører til en svagere tiltrækning end brintbinding.
* London Dispersion Forces: Dette er de svageste intermolekylære kræfter, der er til stede i alle molekyler. De stammer fra midlertidige udsving i elektronfordeling og skaber midlertidige dipoler, der inducerer dipoler i nabolande molekyler. Disse kræfter er især vigtige i ikke -polære molekyler.
Typen og styrken af kræfterne, der holder molekyler sammen, bestemmer stoftilstanden (fast, flydende eller gas) og forskellige andre egenskaber som viskositet, overfladespænding og volatilitet.
 Varme artikler
Varme artikler
-
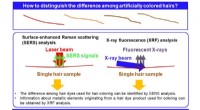 Inden for en hårsbredde – retsmedicinsk identifikation af enkeltfarvet hårstrå nu muligtEn oversigt over de analytiske teknikker, der er brugt i denne undersøgelse, som tilsammen gør det muligt at skelne mellem to enkeltstrå farvet hår. Kredit:Shinsuke Kunimura fra Tokyo University of Sc
Inden for en hårsbredde – retsmedicinsk identifikation af enkeltfarvet hårstrå nu muligtEn oversigt over de analytiske teknikker, der er brugt i denne undersøgelse, som tilsammen gør det muligt at skelne mellem to enkeltstrå farvet hår. Kredit:Shinsuke Kunimura fra Tokyo University of Sc -
 Brug af elektricitet til at øge mængden af data, der kan lagres af DNAen, Digital information kan kodes direkte ind i CRISPR-arrays af en bakteriepopulation ved hjælp af elektroniske signaler. Cellepopulationen kan derefter arkiveres til langtidsopbevaring, propageret t
Brug af elektricitet til at øge mængden af data, der kan lagres af DNAen, Digital information kan kodes direkte ind i CRISPR-arrays af en bakteriepopulation ved hjælp af elektroniske signaler. Cellepopulationen kan derefter arkiveres til langtidsopbevaring, propageret t -
 En ny måde at fjerne generende ioner fra vandKredit:Wageningen Universitet At omdanne havvand til ferskvand er vigtigt i lande med knaphed på vand. Til den proces, visse ladede partikler - kendt som ioner - skal fjernes fra vandet. Imidlerti
En ny måde at fjerne generende ioner fra vandKredit:Wageningen Universitet At omdanne havvand til ferskvand er vigtigt i lande med knaphed på vand. Til den proces, visse ladede partikler - kendt som ioner - skal fjernes fra vandet. Imidlerti -
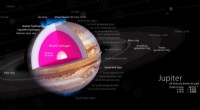 Franske forskere hævder at have skabt metallisk brintDenne udskæring illustrerer en model af det indre af Jupiter, med en stenet kerne dækket af et dybt lag flydende metallisk brint. Kredit:Kelvinsong/Wikimedia Commons Forskere har længe spekuleret
Franske forskere hævder at have skabt metallisk brintDenne udskæring illustrerer en model af det indre af Jupiter, med en stenet kerne dækket af et dybt lag flydende metallisk brint. Kredit:Kelvinsong/Wikimedia Commons Forskere har længe spekuleret
- Hvorfor våbenkontrollove ikke vedtager Kongressen på trods af flertallets offentlig støtte og gen…
- Hvorfor brugte Mendel Pea Plants i sine eksperimenter?
- Udenlandsk fødte løber større risiko for mobning på arbejdspladsen
- Hvordan kan man blive astrofysiker?
- Russisk regulator flytter for at blokere Telegram-beskedapp
- Transistorer er lavet af naturlige bomuldsfibre


