Hvis vand er blevet mættet, vil det fortsætte med at opløse salt?
* Mætningspunkt: Når en opløsning når sit mætningspunkt, betyder det, at det har opløst den maksimale mængde opløst stof (i dette tilfælde salt), som den kan ved en given temperatur og tryk.
* ligevægt: Ved mætning findes der en dynamisk ligevægt. Dette betyder, at hastigheden for saltopløsning i vandet er lig med hastigheden for salt, der krystalliserer ud af opløsningen.
* ikke mere opløst: Da satserne er ens, er der ingen nettoforøgelse i mængden af opløst salt. Eventuelle yderligere salt tilsat vil simpelthen slå sig ned i bunden af beholderen, uopløset.
Tænk på det som en svamp:
* En svamp kan kun absorbere en vis vand, før den er fuld.
* Tilsvarende kan vand kun indeholde en bestemt mængde opløst salt, før det er "fuldt."
For at opløse mere salt skal du:
* Forøg temperaturen: Højere temperaturer giver generelt mulighed for mere opløst stof.
* Skift opløsningsmiddel: Forskellige opløsningsmidler har forskellige opløseligheder for salt.
* Fjern noget af vandet: Dette ville øge koncentrationen af salt, hvilket gør opløsningen mindre mættet.
Sidste artikelHvor mange minims er der i 2 flydende drams?
Næste artikelHvad holder molekyler sammen?
 Varme artikler
Varme artikler
-
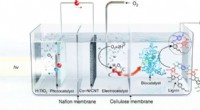 Nyt biokatalytisk system gør affaldsbiomasse til værdiskabende kemikalierSkematisk illustration af den tre-rums foto-elektro-biokemiske reaktor. Kredit:UNIST Et forskerhold, i fællesskab ledet af professor Ji Wook Jang, Professor Yong Hwan Kim, og professor Sang Hoon J
Nyt biokatalytisk system gør affaldsbiomasse til værdiskabende kemikalierSkematisk illustration af den tre-rums foto-elektro-biokemiske reaktor. Kredit:UNIST Et forskerhold, i fællesskab ledet af professor Ji Wook Jang, Professor Yong Hwan Kim, og professor Sang Hoon J -
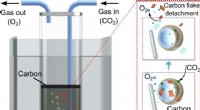 Flydende metal har vist sig at være en billig og effektiv CO2 -omformerUNSW -forskere har hjulpet med at vise, hvordan kuldioxid kan nedbrydes billigt og effektivt via en proces, der opløser fanget CO2 -gas i et opløsningsmiddel omkring nanopartikler af gallium. Kredit:U
Flydende metal har vist sig at være en billig og effektiv CO2 -omformerUNSW -forskere har hjulpet med at vise, hvordan kuldioxid kan nedbrydes billigt og effektivt via en proces, der opløser fanget CO2 -gas i et opløsningsmiddel omkring nanopartikler af gallium. Kredit:U -
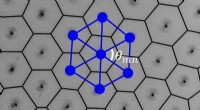 Forskere skaber aktivt materiale ud af mikroskopiske spindende partiklerSelvsamlet dynamisk gitter af spinnere. Voronoi-diagrammet er overlejret med det observerede gitter. Spinnerne er slørede på grund af den lange eksponeringstid, der muliggjorde præcis identifikation a
Forskere skaber aktivt materiale ud af mikroskopiske spindende partiklerSelvsamlet dynamisk gitter af spinnere. Voronoi-diagrammet er overlejret med det observerede gitter. Spinnerne er slørede på grund af den lange eksponeringstid, der muliggjorde præcis identifikation a -
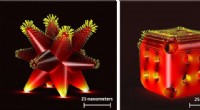 Metalkatalysatorer, der bruges til miljømæssig bæredygtighed, viste sig at nedbrydes og blive min…Nogle af de komplekse strukturelle arrangementer af katalysatorer; venstre er kendt som forgrenet struktur og højre som burstruktur. Kredit:Professor Anna Klinkova fra University of Waterloo Ny fo
Metalkatalysatorer, der bruges til miljømæssig bæredygtighed, viste sig at nedbrydes og blive min…Nogle af de komplekse strukturelle arrangementer af katalysatorer; venstre er kendt som forgrenet struktur og højre som burstruktur. Kredit:Professor Anna Klinkova fra University of Waterloo Ny fo
- Unikke stemmeaftryk i papegøjer kunne hjælpe fugle med at blive genkendt som en flok, uanset hvad …
- Forskere bekræfter en strukturel lighed, der findes i både menneskelige celler og neutronstjerner
- Kinesiske frivillige bruger 200 dage på virtuel månebase
- Hvordan måler du bølgeperioden?
- Lenovo indregner et tab på 189 millioner dollars på et års tab ved engangsafskrivning
- Svampene blandt er de store nedbrydere


