Hvor mange valenselektroner findes i de mest atomer af ædle gasser?
Her er hvorfor:
* ædle gasser er placeret i gruppe 18 (VIIIA) af den periodiske tabel. De er kendt for deres stabilitet og manglende reaktivitet.
* valenselektroner er elektronerne i den yderste skal af et atom, der er involveret i kemisk binding.
* octet -reglen Stater, at atomer har en tendens til at vinde, miste eller dele elektroner for at opnå en stabil konfiguration af otte valenselektroner, som de ædle gasser.
Undtagelser:
* helium (He) , den første ædle gas, har kun 2 Valenselektroner. Dette skyldes, at dets yderste skal er den første skal, som kun kan holde op til to elektroner.
* de tungere ædle gasser (som radon) kan undertiden have mere end 8 valenselektroner i visse situationer.
Langt de fleste ædle gasser har imidlertid 8 valenselektroner, hvilket gør det til det mest almindelige antal.
 Varme artikler
Varme artikler
-
 Nyopdaget materiale kan lette slitage på udenjordiske køretøjerKredit:Pixabay/CC0 Public Domain Mens NASAs Mars Perseverance Rover fortsætter med at udforske Mars overflade, forskere på Jorden har udviklet en ny nanoskala metalcarbid, der kunne fungere som et
Nyopdaget materiale kan lette slitage på udenjordiske køretøjerKredit:Pixabay/CC0 Public Domain Mens NASAs Mars Perseverance Rover fortsætter med at udforske Mars overflade, forskere på Jorden har udviklet en ny nanoskala metalcarbid, der kunne fungere som et -
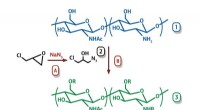 Kemikere får nyt materiale til antibakterielle madbelægningerRUDN University kemikere har udviklet en enkel og bekvem metode til fremstilling af derivater af den naturlige polymer chitosan. Disse derivater er ugiftige og har en udtalt antibakteriel aktivitet på
Kemikere får nyt materiale til antibakterielle madbelægningerRUDN University kemikere har udviklet en enkel og bekvem metode til fremstilling af derivater af den naturlige polymer chitosan. Disse derivater er ugiftige og har en udtalt antibakteriel aktivitet på -
 Crowdfunding af en sfærisk vandflaske, der kan forbruges - Ooho!Kredit:Skipping Rocks Lab (Phys.org)-Et lille team af iværksættere tilknyttet Skipping Rocks Lab har startet en crowdfundingsindsats for at massemarkedsføre en aftapningsanordning til forbrugsvare
Crowdfunding af en sfærisk vandflaske, der kan forbruges - Ooho!Kredit:Skipping Rocks Lab (Phys.org)-Et lille team af iværksættere tilknyttet Skipping Rocks Lab har startet en crowdfundingsindsats for at massemarkedsføre en aftapningsanordning til forbrugsvare -
 Bekæmpelse af de retsmedicinske ubekendte i 3D-trykte skydevåbenJames Cizdziel (højre), UM lektor i kemi og biokemi, og den seneste doktorgrad Oscar Beau Black har brugt to år på at undersøge 3D-printede skydevåben gennem et tilskud fra National Institute of Justi
Bekæmpelse af de retsmedicinske ubekendte i 3D-trykte skydevåbenJames Cizdziel (højre), UM lektor i kemi og biokemi, og den seneste doktorgrad Oscar Beau Black har brugt to år på at undersøge 3D-printede skydevåben gennem et tilskud fra National Institute of Justi
- Hvad er respirationsstedet i bakterier?
- Førende journalister tilslutter sig opfordringen til EU's ophavsretsreform
- Legoer og origami inspirerer næste generations materialer
- Sådan kalibreres en WeighMax-skala
- Scavengers beskytter HDL
- Lås op for styrken af røgkvarts:betydning, helbredende egenskaber og hverdagsbrug


