Hvad viser en kemisk reaktion?
1. Identiteter af reaktanter og produkter:
* Det identificerer klart de stoffer, der reagerer (reaktanter) og de nye stoffer dannet (produkter).
2. Kemisk ændring:
* Det indikerer, at der forekommer en kemisk ændring, hvilket betyder, at atomerne inden for molekylerne omarrangeres. Dette er forskelligt fra en fysisk ændring, hvor stoffets sammensætning forbliver den samme.
3. Støkiometri:
* Den afbalancerede kemiske ligning tilvejebringer de relative mængder reaktanter og produkter involveret i reaktionen. Dette kaldes støkiometri, hvilket hjælper os med at forudsige, hvor meget produkt vi kan få fra en bestemt mængde reaktant.
4. Forandringsretning:
* Pilen i en kemisk ligning indikerer reaktionens retning. Det viser, hvilken vej reaktionen fortsætter, uanset om den er fra reaktanter til produkter eller omvendt.
5. Betingelser:
* Nogle gange viser en kemisk reaktion også de betingelser, der kræves for, at reaktionen skal finde sted, såsom temperatur, tryk eller tilstedeværelsen af en katalysator.
Eksempel:
Reaktionen af brintgas (H₂) med iltgas (O₂) til dannelse af vand (H₂O) er repræsenteret ved følgende kemiske ligning:
2H₂ + O₂ → 2H₂O
Denne ligning fortæller os:
* reaktanter: Brintgas (H₂) og iltgas (O₂)
* Produkter: Vand (H₂O)
* støkiometri: 2 mol H₂ reagerer med 1 mol O₂ for at producere 2 mol H₂O.
* retning: Reaktionen går fra venstre mod højre og danner vand fra brint og ilt.
Fortæl mig, hvis du gerne vil have flere detaljer om et specifikt aspekt af kemiske reaktioner!
Sidste artikelHvilken type gas bygger i blod?
Næste artikelHar ikke -metaller højere kogepunkter eller lavere punkter?
 Varme artikler
Varme artikler
-
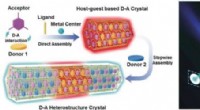 Heterostrukturkrystaller kunne lyse vejen til optiske kredsløbKredit:Wiley-VCH Det kan være muligt at nå nye niveauer af miniaturisering, hastighed, og databehandling med optiske kvantecomputere, som bruger lys til at transportere information. For det, vi ha
Heterostrukturkrystaller kunne lyse vejen til optiske kredsløbKredit:Wiley-VCH Det kan være muligt at nå nye niveauer af miniaturisering, hastighed, og databehandling med optiske kvantecomputere, som bruger lys til at transportere information. For det, vi ha -
 Venstre eller højre molekyler giver en hånd til materielle strukturerEn rekonstruktion af blokcopolymerer set gennem et elektronmikroskop viser tydeligt, hvordan de følger chiraliteten, eller håndfasthed, etableret af deres grundlæggende molekyler og vokser til spiralf
Venstre eller højre molekyler giver en hånd til materielle strukturerEn rekonstruktion af blokcopolymerer set gennem et elektronmikroskop viser tydeligt, hvordan de følger chiraliteten, eller håndfasthed, etableret af deres grundlæggende molekyler og vokser til spiralf -
 Biologisk inspireret, højtydende polyurethan udviklet til strækbar elektronikKredit:CC0 Public Domain En forskergruppe ledet af prof. Zhu Jin ved Ningbo Institute of Materials Technology and Engineering (NIMTE) under det kinesiske videnskabsakademi (CAS) udviklede en polyu
Biologisk inspireret, højtydende polyurethan udviklet til strækbar elektronikKredit:CC0 Public Domain En forskergruppe ledet af prof. Zhu Jin ved Ningbo Institute of Materials Technology and Engineering (NIMTE) under det kinesiske videnskabsakademi (CAS) udviklede en polyu -
 Afslører svindel med kød og fisk med en håndholdt MasSpec Pen på få sekunderMasSpec Pen kan autentificere typen og renheden af kødprøver på så lidt som 15 sekunder. Kredit: Tidsskrift for landbrugs- og fødevarekemi Svindel med kød og fisk er globale problemer, koster f
Afslører svindel med kød og fisk med en håndholdt MasSpec Pen på få sekunderMasSpec Pen kan autentificere typen og renheden af kødprøver på så lidt som 15 sekunder. Kredit: Tidsskrift for landbrugs- og fødevarekemi Svindel med kød og fisk er globale problemer, koster f
- Hvad er det rigtige navn på forbindelse (NH4) 2SO4?
- Ny Drake-ligning til at kvantificere beboelighed?
- Hvad skabte måner mørke områder?
- Hvad er tre forskellige ting, der sker med Solar Energy Earth modtager?
- Undersøgelse:Opvarmning, der allerede er bagt ind, blæser forbi klimamål
- Hvilke skyer gør på himlen?


