Hvad ville der ske med opløseligheden af en gas i vand, hvis volumen blev reduceret, men forblev konstant?
* volumen kan ikke falde og forblive konstant samtidig. Dette er modsatte koncepter.
* opløselighed påvirkes af tryk, ikke kun volumen. Når vi taler om gasopløselighed, er vi virkelig interesseret i det tryk, der udøves af gassen over væsken.
Her er den rigtige måde at forstå forholdet på:
* At reducere volumenet af en beholder, der holder en gas * øges * Trykket. Dette er baseret på Boyle's Law (P₁V₁ =P₂V₂).
* Forøgelse af trykket * øger * opløseligheden af en gas i vand. Dette er Henrys lov, der siger, at opløseligheden af en gas i en væske er direkte proportional med det delvise tryk på gassen over væsken.
Kortfattet: Hvis du reducerer volumenet af en beholder, der holder en gas, øger du trykket, og dette * øger * opløseligheden af gassen i vand.
 Varme artikler
Varme artikler
-
 Forskning i perovskit-silicium tandemceller viser ny vej at gåNREL-forskerne Chuanxiao Xiao (til venstre) og Kai Zhu samarbejdede med forskere fra Republikken Korea for at validere potentialet af perovskit-silicium tandem solceller til at opnå mere end 30 % effe
Forskning i perovskit-silicium tandemceller viser ny vej at gåNREL-forskerne Chuanxiao Xiao (til venstre) og Kai Zhu samarbejdede med forskere fra Republikken Korea for at validere potentialet af perovskit-silicium tandem solceller til at opnå mere end 30 % effe -
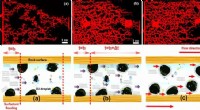 En ny klasse af forgrenede enkeltkædede overfladeaktive stoffer til forbedret olieudvinding rapport…Øverst:Forskelle i bevægelsen af olie gennem mikrokanalerne efter opløsningens oversvømmelse af (a) ren saltlage, b) rent overfladeaktivt stof og (c) overfladeaktivt middel-saltvand. Nederst:Skemati
En ny klasse af forgrenede enkeltkædede overfladeaktive stoffer til forbedret olieudvinding rapport…Øverst:Forskelle i bevægelsen af olie gennem mikrokanalerne efter opløsningens oversvømmelse af (a) ren saltlage, b) rent overfladeaktivt stof og (c) overfladeaktivt middel-saltvand. Nederst:Skemati -
 Brug af glaskeramik i drivhuslamper letter planters vækstForskere fra ITMO i samarbejde med deres kolleger fra Tomsk Polytechnic University kom med en idé om at skabe lyskilder fra keramik med tilføjelse af krom:lyset fra sådanne lamper tilbyder ikke kun rø
Brug af glaskeramik i drivhuslamper letter planters vækstForskere fra ITMO i samarbejde med deres kolleger fra Tomsk Polytechnic University kom med en idé om at skabe lyskilder fra keramik med tilføjelse af krom:lyset fra sådanne lamper tilbyder ikke kun rø -
 Kunstig intelligens hjælper forskere med at producere rekordsættende katalysator til kuldioxid-til…Forskere fra U of T Engineering og Carnegie Mellon University bruger elektrolysatorer som denne til at omdanne affalds-CO2 til kommercielt værdifulde kemikalier. Deres seneste katalysator, designet ti
Kunstig intelligens hjælper forskere med at producere rekordsættende katalysator til kuldioxid-til…Forskere fra U of T Engineering og Carnegie Mellon University bruger elektrolysatorer som denne til at omdanne affalds-CO2 til kommercielt værdifulde kemikalier. Deres seneste katalysator, designet ti
- Ingeniører udvikler AI-system til at opdage ofte savnede kræfttumorer
- Ringer til E.T. et smart træk?
- Hvorfor er det muligt at fremstille levende celler fra ikke -ting som klipper?
- Hvad er en jordbaseret planeter?
- Lausanne tackler giftig jord efter chokfund
- Hvad er ændringen af sedimenter til sten kaldet?


