Hvad tillader vandmolekyler at tiltrække andre molekyler?
* Polaritet: Vandmolekyler har en lidt positiv ladning på brintsiden og en lidt negativ ladning på iltsiden. Denne ujævne fordeling af ladning gør molekylet polær.
* Hydrogenbinding: Den positive brint ende af et vandmolekyle tiltrækkes af den negative ilt ende af et andet vandmolekyle. Denne attraktive kraft kaldes en brintbinding.
Disse brintbindinger er relativt svage sammenlignet med kovalente bindinger, men de er stærke nok til at holde vandmolekyler sammen, hvilket giver vand sine unikke egenskaber som:
* Høj overfladespænding: Den stærke attraktion mellem vandmolekyler gør det vanskeligt at bryde overfladen, så insekter kan gå på vandet.
* Højt kogepunkt: Hydrogenbindinger kræver en masse energi for at bryde, hvorfor vand har et relativt højt kogepunkt.
* Fremragende opløsningsmiddel: Vands polaritet giver det mulighed for at opløse mange ioniske og polære stoffer.
Så det er kombinationen af polaritet og hydrogenbinding Det giver vandmolekyler mulighed for at tiltrække andre molekyler, give vand sine unikke egenskaber og gøre det vigtigt for livet.
Sidste artikelHar alkalimetaller evnen til at plette?
Næste artikelHvad hopper molekyler rundt i?
 Varme artikler
Varme artikler
-
 Potentielle antimikrobielle fundet, der viser løfte om bekæmpelse af stafylokokinfektionerEric Brown (til venstre), professor i biokemi og biomedicinsk videnskab, og Omar El-Halfawy, en postdoc i biokemi og biomedicinske videnskaber, ved McMaster University. Kredit:McMaster University
Potentielle antimikrobielle fundet, der viser løfte om bekæmpelse af stafylokokinfektionerEric Brown (til venstre), professor i biokemi og biomedicinsk videnskab, og Omar El-Halfawy, en postdoc i biokemi og biomedicinske videnskaber, ved McMaster University. Kredit:McMaster University -
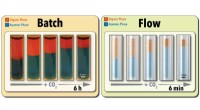 Grøn tilgang fremskynder procesoptimering og hentning af omskiftelige opløsningsmidlerKredit:North Carolina State University Forskere ved North Carolina State University har demonstreret en ny, grøn teknologi til både accelereret screening og hentning af omskiftelige opløsningsmidl
Grøn tilgang fremskynder procesoptimering og hentning af omskiftelige opløsningsmidlerKredit:North Carolina State University Forskere ved North Carolina State University har demonstreret en ny, grøn teknologi til både accelereret screening og hentning af omskiftelige opløsningsmidl -
 Nye fremskridt for at reducere defekter i multimaterialer ved hjælp af rettet energiaflejringIfølge undersøgelsen kan manipulation af gradientforholdet mellem komponentmaterialerne under rettet energiaflejring (en 3D-printteknik) føre til højtydende funktionelle materialer med minimale defekt
Nye fremskridt for at reducere defekter i multimaterialer ved hjælp af rettet energiaflejringIfølge undersøgelsen kan manipulation af gradientforholdet mellem komponentmaterialerne under rettet energiaflejring (en 3D-printteknik) føre til højtydende funktionelle materialer med minimale defekt -
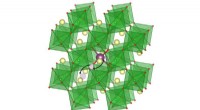 Lithium-ioner strømmer gennem fast materialeLithiumioner diffunderer hurtigt inden for gitteret af en stærkt korreleret perovskit kaldet samariumnikkelat. Kvanteberegninger viser, at denne hurtige shuttle opstår på grund af den lave termodynami
Lithium-ioner strømmer gennem fast materialeLithiumioner diffunderer hurtigt inden for gitteret af en stærkt korreleret perovskit kaldet samariumnikkelat. Kvanteberegninger viser, at denne hurtige shuttle opstår på grund af den lave termodynami


