Hvordan danner en spontan reaktion 298 K?
nøgle ligningen:
* ΔG =ΔH - TΔS
Hvor:
* ΔG er ændringen i Gibbs fri energi (negativ middel spontan)
* ΔH er ændringen i entalpi (varmeændring, negativ middel eksoterm)
* t er temperaturen i Kelvin (298 K i dit tilfælde)
* ΔS er ændringen i entropi (lidelse, positiv betyder mere lidelse)
hvordan man bestemmer, om en reaktion er spontan ved 298 K:
1. entalpi (ΔH): Hvis reaktionen er eksoterm (frigiver varme, ΔH er negativ), bidrager den til spontanitet.
2. entropi (ΔS): Hvis reaktionen øger lidelsen (ΔS er positiv), bidrager den også til spontanitet.
3. Temperatur (t): Ved højere temperaturer bliver entropiudtrykket (TΔS) mere signifikant.
Sådan fungerer det:
* negativ ΔG: Reaktionen er spontan. Systemet bevæger sig mod en lavere fri energistat.
* positiv ΔG: Reaktionen er ikke-spontan. Energiindgang er påkrævet for at reaktionen kan forekomme.
* ΔG =0: Reaktionen er ved ligevægt; Ingen nettoændring observeres.
Eksempel:
Lad os sige, at du har en reaktion, hvor:
* ΔH =-50 kJ/mol (eksoterm)
* ΔS =+100 J/Mol · K (øget lidelse)
Ved 298 K:
* ΔG =-50 kJ/mol - (298 K) (+100 j/mol · K)
* ΔG =-50 kJ/mol - 29,8 kJ/mol
* ΔG =-79,8 kJ/mol
Da ΔG er negativ, er reaktionen spontan ved 298 K.
Vigtige noter:
* Dette fortæller os, om en reaktion * kan * ske, ikke * hvor hurtigt * det vil ske.
* Reaktionen kan være termodynamisk foretrukket, men kinetisk langsom, hvilket betyder, at det kan tage lang tid at nå ligevægt.
* Ligningen tegner sig ikke for katalysatorer, som kan fremskynde reaktioner uden at ændre deres spontanitet.
Fortæl mig, hvis du gerne vil udforske mere specifikke reaktioner eller have andre spørgsmål!
Sidste artikelHvad er kemiske klipper dannet af?
Næste artikelHvad er de 2 hoveddele af en kemisk ligning?
 Varme artikler
Varme artikler
-
 Klistermærker og en smartphone til nem nitritpåvisning på fødevarerEn ny film reagerer på nitritanioner gennem en farveændring, der bliver mørkere med højere nitritniveauer. Kredit:Tilpasset fra ACS Applied Materials &Interfaces 2022, DOI:10.1021/acsami.2c09467 Ni
Klistermærker og en smartphone til nem nitritpåvisning på fødevarerEn ny film reagerer på nitritanioner gennem en farveændring, der bliver mørkere med højere nitritniveauer. Kredit:Tilpasset fra ACS Applied Materials &Interfaces 2022, DOI:10.1021/acsami.2c09467 Ni -
 Kunne varmen fra jordskorpen blive den ultimative energikilde?Her, bygningens højde repræsenterer elektronernes energitilstand. Elektroner i halvlederlaget stiger til en højenergitilstand ved at blive termisk exciterede og overføres derefter til elektrontranspor
Kunne varmen fra jordskorpen blive den ultimative energikilde?Her, bygningens højde repræsenterer elektronernes energitilstand. Elektroner i halvlederlaget stiger til en højenergitilstand ved at blive termisk exciterede og overføres derefter til elektrontranspor -
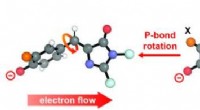 Hvordan elektriske felter påvirker et molekylært twist i lysfølsomme proteinerNår lys rammer visse kromoforer i proteiner, det får dem til at vride sig og ændre form. Denne atomare rekonfiguration, kendt som fotoisomerisering, ændrer molekylets kemiske og fysiske egenskaber. Ke
Hvordan elektriske felter påvirker et molekylært twist i lysfølsomme proteinerNår lys rammer visse kromoforer i proteiner, det får dem til at vride sig og ændre form. Denne atomare rekonfiguration, kendt som fotoisomerisering, ændrer molekylets kemiske og fysiske egenskaber. Ke -
 Super svamp lover effektiv giftig oprydning af søer og mereDen hvide svamp blev hentet fra en lokal butik. Efter ændring med nanoteknologi, den samme svamp, nu rød, fanger kviksølv og dræber mikrober. Kredit:Ke Xu, kandidatstuderende, CFANS Kviksølv er me
Super svamp lover effektiv giftig oprydning af søer og mereDen hvide svamp blev hentet fra en lokal butik. Efter ændring med nanoteknologi, den samme svamp, nu rød, fanger kviksølv og dræber mikrober. Kredit:Ke Xu, kandidatstuderende, CFANS Kviksølv er me
- Hvilke forskellige steder bruger astronomer referencepunkter?
- Forskere demonstrerer højeffektiv emission af dispersiv bølge i gasfyldte hulkerne fotoniske kryst…
- Hvilke langsomme processer ændrer jordens form?
- Hvad er mikrokultur?
- Ny metode opnår 4D-billeddannelse af væsker i porer
- Byer henvender sig til afsaltning for vandsikkerhed, men til hvilken pris?


