Hvad sker der med produkternes bindinger under en kemisk reaktion?
* reaktanter: Dette er udgangsmaterialerne for en kemisk reaktion. De har deres egne specifikke bindinger, der holder deres atomer sammen.
* Breaking Bonds: For at en reaktion skal forekomme, skal der leveres energi for at bryde de eksisterende bindinger inden for reaktanterne. Denne energi kan komme fra varme, lys eller andre former for energi.
* Dannelse af nye obligationer: Når bindingerne i reaktanterne er brudt, omarrangeres atomerne og danner nye bindinger, hvilket skaber produkterne.
* Energiændringer: Kemiske reaktioner kan enten frigive energi (eksotermiske reaktioner) eller kræve energi for at fortsætte (endotermiske reaktioner). Energiændringen er relateret til forskellen i styrken af de brudte obligationer og de dannede obligationer.
Nøglepunkter:
* Ikke alle obligationer bryder og form: Nogle reaktioner involverer kun en delvis brud og dannelse af bindinger.
* obligationsstyrke: Styrken af obligationerne påvirker den energi, der er nødvendig for at bryde dem og den frigivne energi, når de dannes.
* katalysator: Nogle kemiske reaktioner fremskyndes af katalysatorer, hvilket sænker den aktiveringsenergi, der er nødvendig for at bryde de indledende bindinger.
Eksempel:
Lad os tage det enkle eksempel på reaktionen mellem brintgas (H₂) og iltgas (O₂) for at danne vand (H₂O):
* reaktanter: H₂ og O₂
* Bond Breaking: Bindingerne i brint- og iltmolekyler skal brydes.
* obligationsdannelse: Nye bindinger dannes mellem brint- og iltatomer, hvilket resulterer i dannelse af vandmolekyler (H₂O).
I det væsentlige involverer den kemiske transformation under en reaktion brud og fremstilling af kemiske bindinger, som i sidste ende fører til dannelse af nye stoffer med forskellige egenskaber.
 Varme artikler
Varme artikler
-
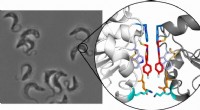 Ny terapeutisk tilgang til bekæmpelse af afrikansk sovesygeTrypanosomer, som forårsager afrikansk sovesyge, under mikroskopet (til venstre) og krystalstrukturen af tryparedoxin-dimeren (til højre):De to inhibitormolekyler er fremhævet med rødt. Kredit:Ute H
Ny terapeutisk tilgang til bekæmpelse af afrikansk sovesygeTrypanosomer, som forårsager afrikansk sovesyge, under mikroskopet (til venstre) og krystalstrukturen af tryparedoxin-dimeren (til højre):De to inhibitormolekyler er fremhævet med rødt. Kredit:Ute H -
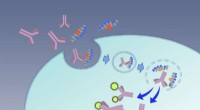 Særlig levering:Makromolekyler via edderkopper biderForskere ombygger edderkoppegift, så endosomer kan levere sin last mere effektivt i cellerne. Kredit:Kyoto University Vores celler er rige på proteiner, som er potentielle mål for terapi. Men unde
Særlig levering:Makromolekyler via edderkopper biderForskere ombygger edderkoppegift, så endosomer kan levere sin last mere effektivt i cellerne. Kredit:Kyoto University Vores celler er rige på proteiner, som er potentielle mål for terapi. Men unde -
 Forskere laver gigantiske molekylære bure til energiomdannelse og medicinafgivelseEt diagram, der viser den molekylære burstruktur. Kredit:Professor Wolfgang Schmitt, Trinity College Dublin Forskere fra Trinity College Dublin og AMBER, det Science Foundation Ireland-finansiered
Forskere laver gigantiske molekylære bure til energiomdannelse og medicinafgivelseEt diagram, der viser den molekylære burstruktur. Kredit:Professor Wolfgang Schmitt, Trinity College Dublin Forskere fra Trinity College Dublin og AMBER, det Science Foundation Ireland-finansiered -
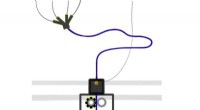 Overlegen bio-blæk til 3-D-print blev banebrydendeDette 3D-printsystem ville udskrive gel stilladser, eller støttestrukturer, til dyrkning af menneskeligt væv. Ligesom traditionelle printere, der er afhængige af fire pigmenter til at dække hele farve
Overlegen bio-blæk til 3-D-print blev banebrydendeDette 3D-printsystem ville udskrive gel stilladser, eller støttestrukturer, til dyrkning af menneskeligt væv. Ligesom traditionelle printere, der er afhængige af fire pigmenter til at dække hele farve
- Et eksempel på en polymerforbindelse
- Ville det være korrekt at sige, at inerti får bevægende objekt til at fortsætte med at bevæge s…
- Hvad er forskellen mellem modstand og konduktivitet?
- Hvordan spredes burr frø af dyr?
- Konform meta -overfladebelægning eliminerer krydstale og krymper bølgeledere
- Er det muligt at se to solskin?


