Ny terapeutisk tilgang til bekæmpelse af afrikansk sovesyge
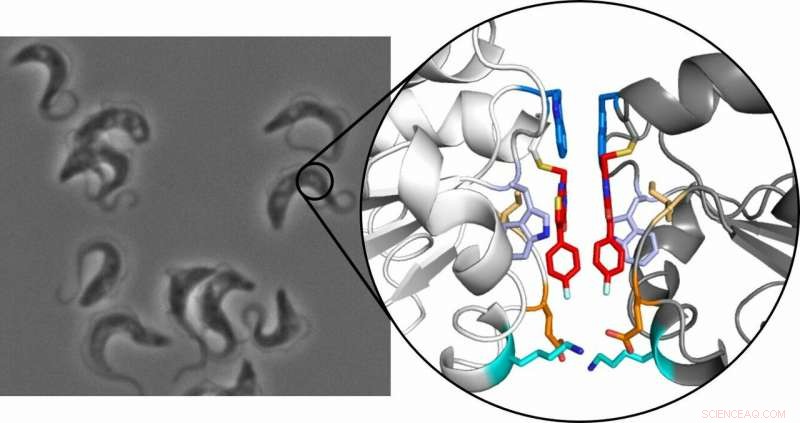
Trypanosomer, som forårsager afrikansk sovesyge, under mikroskopet (til venstre) og krystalstrukturen af tryparedoxin-dimeren (til højre):De to inhibitormolekyler er fremhævet med rødt. Kredit:Ute Hellmich, Annika Wagner
Forskere, der arbejder inden for en række discipliner, gik sammen for at identificere en ny tilgang til bekæmpelse af afrikansk sovesyge. Grundlæggende forskning udført under vejledning af professor Ute Hellmich fra Johannes Gutenberg University Mainz (JGU) har afsløret en lovende strategi for at udvikle en passende agent. "Der er stadig lang vej igen, før vi når frem til et farmaceutisk produkt, " sagde Hellmich. "Men vores meget tværfaglige arbejde, der involverer parasitologi, teoretisk og organisk kemi, strukturel biologi, og biokemi har vist, hvordan parasitten, der forårsager sovesyge, kan uskadeliggøres." Det lykkedes forskerne at påvise, hvordan et specifikt hæmmende stof sætter sig fast på og deaktiverer et vigtigt protein i parasitten.
Afrikansk sovesyge er forårsaget af trypanosomer, encellede protozoer, der overføres ved bid af en inficeret tsetseflue. Ifølge Verdenssundhedsorganisationen, antallet af smittede er faldet de seneste år, ned til anslået 15, 000 i 2014. Dog det er svært at fastslå den faktiske forekomst af sygdommen, da de tidlige symptomer ligner dem ved malaria. "Ikke kun de fattigste mennesker i Afrika syd for Sahara er truet, men også deres kvæg, som er påvirket i dramatisk skala af visse arter af Trypanosoma brucei, " forklarede biokemiker professor Ute Hellmich.
I øjeblikket, kun en håndfuld medicin til behandling af sovesyge, som er dødelig, hvis den ikke behandles, er tilgængelige, og disse behandlinger er ofte ledsaget af alvorlige bivirkninger og endda dødsfald hos op til 10 procent af patienterne. Selvom der i øjeblikket udvikles nye lægemidler, tilgangen fra Hellmichs gruppe går et skridt videre:"Vores inhibitor åbner op for fremtidens udsigter til at kunne designe inhibitorer på et grundlæggende niveau og kan dermed muligvis også bruges i behandlingen af infektion med andre, relaterede patogene parasitter, såsom Leishmania, sagde Annika Wagner, hovedforfatter af undersøgelsen for nylig offentliggjort i Angewandte Chemie International Edition .
Inhibitor inducerer dimerisering af essentielt parasitprotein
Princippet bygger på, at en lille, selektiv inhibitor binder til enzymet tryparedoxin. Dette protein er essentielt for parasitten, beskytter det mod oxidativ skade, men er ikke til stede hos mennesker, gør det til et levedygtigt lægemiddelmål. Til deres overraskelse, teamet af forskere opdagede, at når inhibitoren binder sig til proteinet, to af de resulterende inhibitor-proteinkomplekser kombineres derefter for at danne en stabil dimer. Når dette sker, det normalt monomere protein holder op med at fungere.
"Vi var forbløffede og troede først, at det var en tilfældig effekt på grund af eksperimentelle forhold, " sagde Hellmich. Efterforskningen blev derefter udvidet, og det blev verificeret i en storstilet undersøgelse ved hjælp af forskellige metoder, at dimeriseringseffekten kunne reproduceres. Ud over forskerholdene i Mainz af professor Ute Hellmich og professor Till Opatz, forskere fra universiteterne i Frankfurt, Würzburg, Heidelberg, og European Molecular Biology Laboratory (EMBL) i Grenoble var involveret.
Meget tværfaglig forskning viser sig at være vellykket
Den dimerisering, som forskningen har afsløret, er usædvanlig, fordi det ansvarlige molekyle er ekstremt lille. De fleste molekyler, der fungerer som et molekylært klæbemiddel til at kombinere individuelle monomerer for at danne en dimer, er relativt store. "Vores molekyle er meget mindre og i stand til direkte at genkende proteinet, " forklarede Hellmich. Små molekyler er også nemmere at smugle ind i celler, som kan være udgangspunktet for nye lægemiddelkoncepter.
Ved præcist at demonstrere mekanismen, hvorved parasitproteinet hæmmes og dimeriseres kemisk af det lille molekyle, det tværfaglige forskningspartnerskab har fastlagt de grundlæggende elementer, der ligger til grund for et sådant nyt koncept. "Det var afgørende, at vi ikke stoppede ved vores oprindelige mål om blot at bestemme krystalstrukturen af protein-hæmmerkomplekset, sagde Hellmich. I stedet, vi tog endnu et kig på resultatet og diskuterede det derefter med eksperter fra forskellige områder. Forskningen skrider kun frem, når vi arbejder sammen."
 Varme artikler
Varme artikler
-
 Blod og sved:Bærbare medicinske sensorer vil få et stort følsomhedsforøgelseBiosensor layout (en, c). Bølgelederen er inde i det dielektriske substrat. Resonatoren, realiseret som en ringbølgeleder, er placeret ved grænsefladen mellem det dielektriske materiale og den biologi
Blod og sved:Bærbare medicinske sensorer vil få et stort følsomhedsforøgelseBiosensor layout (en, c). Bølgelederen er inde i det dielektriske substrat. Resonatoren, realiseret som en ringbølgeleder, er placeret ved grænsefladen mellem det dielektriske materiale og den biologi -
 Klimavenlig arkitektur takket være naturlige foldemekanismerBevægelige komponenter i bygninger såsom persienner, hvis struktur er baseret på kogler af nåletræ, som åbner eller lukker i tilfælde af tørhed på grund af deres stofs forskellige kvældeadfærd. Kredit
Klimavenlig arkitektur takket være naturlige foldemekanismerBevægelige komponenter i bygninger såsom persienner, hvis struktur er baseret på kogler af nåletræ, som åbner eller lukker i tilfælde af tørhed på grund af deres stofs forskellige kvældeadfærd. Kredit -
 Parasitforskning varmer opIntracellulære Toxoplasma -parasitter, der udtrykker den genetisk kodede calciumindikator GCaMP. Parasitter blev behandlet med A23187, en forbindelse, der forårsager tilstrømning af calcium og stimule
Parasitforskning varmer opIntracellulære Toxoplasma -parasitter, der udtrykker den genetisk kodede calciumindikator GCaMP. Parasitter blev behandlet med A23187, en forbindelse, der forårsager tilstrømning af calcium og stimule -
 Kemikere viser, at natrium sikkert kan bruges til krydskoblingsreaktionerFremstilling af organometalliske forbindelser og de efterfølgende krydskoblingsreaktioner. en, Overgangsmetal-katalyserede krydskoblingsreaktioner. b, Almindelige metoder til fremstilling af organozin
Kemikere viser, at natrium sikkert kan bruges til krydskoblingsreaktionerFremstilling af organometalliske forbindelser og de efterfølgende krydskoblingsreaktioner. en, Overgangsmetal-katalyserede krydskoblingsreaktioner. b, Almindelige metoder til fremstilling af organozin
- Over for orkanens oversvømmelser, Den amerikanske by tager lærdom af fortiden
- Google hædrer den legendariske maratonløber Tom Longboat
- Hvad er gallbladderens primære funktion?
- Det kunne være på tide at begynde at tænke på en kybernetisk Bill of Rights
- Lunar krater radioteleskop:Oplyser den kosmiske mørke middelalder
- Grafenskum detekterer sprængstoffer, emissioner bedre end nutidens gassensorer


