Hvor meget opløst stof er der i en løsning?
* Koncentration: Dette fortæller dig mængden af opløst stof, der er til stede i en bestemt mængde opløsningsmiddel eller opløsning. Almindelige koncentrationsenheder inkluderer:
* Molaritet (M): Mol opløst stof pr. Liter opløsning.
* molalitet (m): Mol opløst stof pr. Kg opløsningsmiddel.
* Procent efter masse: Masse af opløst stof pr. 100 gram opløsning.
* Procent i volumen: Volumen af opløst stof pr. 100 ml opløsning.
* masse af løsning: Den samlede vægt af opløsningen (opløsningsmiddel + opløsningsmiddel).
* Løsningsvolumen: Det samlede volumen af opløsningen (opløsningsmiddel + opløsningsmiddel).
Her er hvordan man beregner mængden af opløst stof:
1. Hvis du kender koncentrationen:
* Molaritet (M): Mol af opløst stof =molaritet x mængde opløsning (i liter)
* molalitet (m): Mol af opløst stof =molalitet x masse opløsningsmiddel (i kilogram)
* Procent efter masse: Masse af opløst stof =(procent efter masse / 100) x masse af opløsning
* Procent i volumen: Volumen af opløst stof =(procent efter volumen / 100) x mængde opløsning
2. Hvis du kender massen eller volumenet på opløsningen og koncentrationen:
* Brug koncentrationen til at beregne massen eller mængden af opløst stof, konverter derefter til mol, hvis det er nødvendigt.
Eksempel:
Lad os sige, at du har en 0,5 m opløsning af glukose (C6H12O6) med et volumen på 250 ml.
1. konverter ml til l: 250 ml =0,25 l
2. Beregn mol glukose: Mol =0,5 m x 0,25 l =0,125 mol glukose
Derfor er der 0,125 mol glukose i opløsningen.
 Varme artikler
Varme artikler
-
 Vurdering af virkningen af tabsmekanismer i solcellekandidat antimonsulfidselenidKredit:Pixabay/CC0 Public Domain Mens klimaændringer fortsætter med at præsentere sig selv som den mest presserende trussel, vores planet står over for, presser forskere på for at finde effektive o
Vurdering af virkningen af tabsmekanismer i solcellekandidat antimonsulfidselenidKredit:Pixabay/CC0 Public Domain Mens klimaændringer fortsætter med at præsentere sig selv som den mest presserende trussel, vores planet står over for, presser forskere på for at finde effektive o -
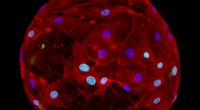 Gel dråber til regenerativ medicinCellebærende geler lavet af selvsamlende ultrakorte peptider kan producere menneskelignende væv, der kan bruges til regenerative terapier. Kredit:KAUST; Gustavo Ramirez Calderon Geldråber i mikrom
Gel dråber til regenerativ medicinCellebærende geler lavet af selvsamlende ultrakorte peptider kan producere menneskelignende væv, der kan bruges til regenerative terapier. Kredit:KAUST; Gustavo Ramirez Calderon Geldråber i mikrom -
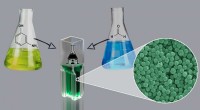 Kemikere udvikler metode til at opnå katalysator-, overfladeaktive og skabelonfrie polymere nanopar…Reaktion udviklet af RUDN -kemikere indeholder to monomerer - 3 -aminophenol og formaldehyd. Kredit:Allen Dressen En kemiker fra RUDN foreslår en simpel teknologi til fremstilling af polymere nano
Kemikere udvikler metode til at opnå katalysator-, overfladeaktive og skabelonfrie polymere nanopar…Reaktion udviklet af RUDN -kemikere indeholder to monomerer - 3 -aminophenol og formaldehyd. Kredit:Allen Dressen En kemiker fra RUDN foreslår en simpel teknologi til fremstilling af polymere nano -
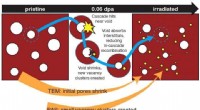 Ikke-destruktive positronstråler sondeskade, understøtte sikkerhedsfremskridt i strålingsmiljøerEn kombination af positron-annihilationsspektroskopi og transmissionselektronmikroskopi afslører ny indsigt i, hvordan skader dannes i bestrålede materialer, foreslår en mekanisme, hvor store huller i
Ikke-destruktive positronstråler sondeskade, understøtte sikkerhedsfremskridt i strålingsmiljøerEn kombination af positron-annihilationsspektroskopi og transmissionselektronmikroskopi afslører ny indsigt i, hvordan skader dannes i bestrålede materialer, foreslår en mekanisme, hvor store huller i
- Levende cellemembraner kan selvsortere deres komponenter ved afblanding
- Blandende bobler afslører, hvordan flydende skum udvikler sig
- Hvordan måler du afstanden til stjerner med parallax?
- Virker vejledning? En uddannelsesøkonom undersøger beviserne for, om det er effektivt
- Fuldt inkjet-printede vanadiumdioxid-baserede radiofrekvensomskiftere til fleksible rekonfigurerbare…
- Hvordan man forudsiger det uforudsigelige i et forandret klima


