Hvordan adskiller koncentrationen af vand sig i opløsning?
1. Rent vand:
* Højeste koncentration: Rent vand har den højeste koncentration af vandmolekyler, da det kun indeholder vand.
* Molaritet: Molariteten af rent vand er ca. 55,5 m (mol pr. Liter).
2. Løsninger:
* lavere koncentration: Når et opløst stof (som salt, sukker eller et kemikalie) opløses i vand, falder koncentrationen af vandmolekyler.
* fortynding: Jo mere opløselig tilsat, jo mere fortyndet bliver vandet.
* koncentration afhænger af opløst stof: Den specifikke koncentration af vand vil variere afhængigt af mængden og typen af tilstedeværende opløst stof.
* Eksempel: En saltvandopløsning (NaCl opløst i vand) vil have en lavere koncentration af vandmolekyler end rent vand.
Måling af vandkoncentration:
Selvom det ikke er typisk at direkte måle koncentrationen af vand i opløsninger, kan vi udlede dens koncentration af:
* molaritet af opløst stof: At kende molariteten af opløst stoffet giver os mulighed for at beregne vandets molaritet i betragtning af det samlede volumen af opløsningen.
* Måling af andre egenskaber: Nogle egenskaber ved opløsninger, som damptryk, frysepunkt eller osmotisk tryk, påvirkes af vandkoncentrationen, hvilket giver os mulighed for at udlede dens koncentration.
Nøglepunkt: Koncentrationen af vand i en opløsning er omvendt proportional med koncentrationen af opløsningen. Jo mere opløselig til stede, jo lavere er koncentrationen af vandmolekyler.
Sidste artikelHvad hedder stoffet på venstre side af en ligning?
Næste artikelHvor meget opløst stof er der i en løsning?
 Varme artikler
Varme artikler
-
 Fuldende billedet af mikronæringsstoffer for plantebaserede mælkealternativerKredit:Pixabay/CC0 Public Domain Plantebaserede mælkealternativer er en attraktiv mulighed for folk med allergi eller intolerance, eller som foretrækker en mælkefri diæt. Men fordi nogle essentiell
Fuldende billedet af mikronæringsstoffer for plantebaserede mælkealternativerKredit:Pixabay/CC0 Public Domain Plantebaserede mælkealternativer er en attraktiv mulighed for folk med allergi eller intolerance, eller som foretrækker en mælkefri diæt. Men fordi nogle essentiell -
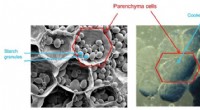 Ny forarbejdningsteknik kan gøre kartofler sundereMikroskopisk billede af kartoffelvæv før (venstre) og efter (højre) kogning eller forarbejdning. Kredit:Amy Lin, A*STAR, og Yijing Shao og YuLian Lin, University of Idaho. Forskere annoncerede tidl
Ny forarbejdningsteknik kan gøre kartofler sundereMikroskopisk billede af kartoffelvæv før (venstre) og efter (højre) kogning eller forarbejdning. Kredit:Amy Lin, A*STAR, og Yijing Shao og YuLian Lin, University of Idaho. Forskere annoncerede tidl -
 Usædvanlig biosyntetisk vej tilbyder en nøgle til fremtidig naturlig produktopdagelseWilfred van der Donk, Richard E. Heckert begavet stol i kemi og direktør for kandidatstudier ved University of Illinois, og Howard Hughes Medical Institute Investigator. Kredit:L. Brian Stauffer B
Usædvanlig biosyntetisk vej tilbyder en nøgle til fremtidig naturlig produktopdagelseWilfred van der Donk, Richard E. Heckert begavet stol i kemi og direktør for kandidatstudier ved University of Illinois, og Howard Hughes Medical Institute Investigator. Kredit:L. Brian Stauffer B -
 Forskere klemmer katalysatorer inde i værtsmaterialer som et skib i en flaskeVed hjælp af termodynamiske Pourbaix-diagrammer, videnskabsmænd kan presse katalysatorer inde i værtsmaterialer som et skib i en flaske. Kredit:Jingwei Hou Forskere ved Queen Mary University of Lo
Forskere klemmer katalysatorer inde i værtsmaterialer som et skib i en flaskeVed hjælp af termodynamiske Pourbaix-diagrammer, videnskabsmænd kan presse katalysatorer inde i værtsmaterialer som et skib i en flaske. Kredit:Jingwei Hou Forskere ved Queen Mary University of Lo
- Forskere kaster nyt lys over påvisning af influenza
- Hvad kaldes det, når partikler er i stand til at flyde over hinanden?
- Lucky MESSENGER-data ophæver en langvarig idé om Venus-atmosfære
- Hvorfor er påstande om, at nuklear fusion forekommer ved stuetemperatur urealistisk?
- Hvordan ville mangfoldigheden af organiske forbindelser være forskellige, hvis kulstof havde syv …
- En hær af mikrorobotter kan udslette tandplak


