Hvad sker der fysisk, når vand opløser et stof?
1. Polaritet og tiltrækning
* vand er et polært molekyle: Dets iltatom har en lidt negativ ladning, og dets brintatomer har lidt positive ladninger. Dette skaber et dipolmoment inden for vandmolekylet.
* opløste stoffer kan være polære eller ikke-polære:
* polære opløste stoffer: Har en ujævn fordeling af elektroner, hvilket skaber delvis positive og negative afgifter. Tænk på bordsalt (NaCl), hvor natrium (NA) er positivt ladet, og klor (CL) er negativt ladet.
* Ikke-polære opløste stoffer: Har en jævn fordeling af elektroner, hvilket betyder ingen signifikant adskillelse af ladninger. Tænk på olie eller fedt.
* "som opløser som": Polære stoffer opløses godt i polære opløsningsmidler (som vand), mens ikke-polære stoffer opløses godt i ikke-polære opløsningsmidler (som olie). Dette skyldes, at de attraktive kræfter mellem molekylerne i opløst stof og opløsningsmiddel er stærkere end kræfterne, der holder de opløste molekyler sammen.
2. Opløsningsprocessen
* omgivende opløsning: Når et polært opløst stof som salt (NaCl) tilsættes til vand, omgiver vandmolekylerne de individuelle saltioner (Na+ og Cl-). De negative ender af vandmolekylerne (ilt) orienterer sig mod de positivt ladede natriumioner og de positive ender af vandmolekylerne (brint) orienterer sig mod de negativt ladede chloridioner.
* bryder opløsningen fra hinanden: Denne interaktion skaber en stærk attraktion mellem vandmolekylerne og ionerne, og trækker dem effektivt fra saltkrystallen.
* Hydratiseringsskal: Vandmolekylerne, der omgiver ionerne, danner en hydratiseringsskal, hvilket holder ionerne adskilt og opløst i opløsningen.
3. Faktorer, der påvirker opløselighed
* Temperatur: Generelt øger øget temperaturen opløselighed, fordi molekylerne har mere energi til at overvinde attraktive kræfter.
* tryk: Trykket har en større effekt på opløseligheden af gasser. Højere tryk tvinger flere gasmolekyler til opløsning.
* Polaritet: Som nævnt tidligere spiller polariteten af både opløst stof og opløsningsmiddel en afgørende rolle i bestemmelsen af opløselighed.
Vigtig note:
* Ikke alle stoffer opløses i vand. Nogle stoffer, som sand eller olie, er ikke meget opløselige i vand, fordi kræfterne mellem deres molekyler er stærkere end attraktionen til vandmolekyler.
Fortæl mig, hvis du gerne vil have en mere detaljeret forklaring af nogen af disse punkter!
Sidste artikelAtommassen af et atom er baseret på en sammenligning med svovl-32?
Næste artikelEr alle fysiske reaktioner reversible?
 Varme artikler
Varme artikler
-
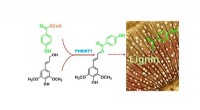 Forskere ID -enzym til fremstilling af nøgleindustrielt kemikalie i planterBrookhaven Lab-forskere identificerede et enzym (PHBMT1), der overfører p-hydoxybenzoat (grønt) til lignin-byggesten i poppel. Det resulterende konjugat inkorporeres derefter i den spirende ligninpoly
Forskere ID -enzym til fremstilling af nøgleindustrielt kemikalie i planterBrookhaven Lab-forskere identificerede et enzym (PHBMT1), der overfører p-hydoxybenzoat (grønt) til lignin-byggesten i poppel. Det resulterende konjugat inkorporeres derefter i den spirende ligninpoly -
 Nyt katalysatormateriale producerer rigeligt billigt brintKredit:CC0 Public Domain QUT-kemiforskere har opdaget billigere og mere effektive materialer til fremstilling af brint til lagring af vedvarende energi, der kan erstatte nuværende vandspaltningska
Nyt katalysatormateriale producerer rigeligt billigt brintKredit:CC0 Public Domain QUT-kemiforskere har opdaget billigere og mere effektive materialer til fremstilling af brint til lagring af vedvarende energi, der kan erstatte nuværende vandspaltningska -
 Det er smart at sy! Forskere opfinder tråde for at opdage gasser, når de er vævet ind i tøjFøletråde forberedt med bromthymolblåt (overtråd), methylrød (mellemtråd) og MnTPP (bundtråd) udsættes for ammoniak ved 0 ppm (venstre panel), 50 ppm (midterste panel) og 1000 ppm (højre panel). Kredi
Det er smart at sy! Forskere opfinder tråde for at opdage gasser, når de er vævet ind i tøjFøletråde forberedt med bromthymolblåt (overtråd), methylrød (mellemtråd) og MnTPP (bundtråd) udsættes for ammoniak ved 0 ppm (venstre panel), 50 ppm (midterste panel) og 1000 ppm (højre panel). Kredi -
 Ændring af silkeorms diæt til at spinde stærkere silkeSilkeormen og dens CNF-holdige foder. Kredit:Tohoku University Tohoku University forskere har produceret cellulose nanofiber (CNF) syntetiseret silke naturligt gennem en simpel tweak til silkeorms
Ændring af silkeorms diæt til at spinde stærkere silkeSilkeormen og dens CNF-holdige foder. Kredit:Tohoku University Tohoku University forskere har produceret cellulose nanofiber (CNF) syntetiseret silke naturligt gennem en simpel tweak til silkeorms


