Atommassen af et atom er baseret på en sammenligning med svovl-32?
Her er hvorfor:
* carbon-12 er standarden: Carbon-12 defineres som at have en atommasse på nøjagtigt 12 atommasseenheder (AMU). Dette betyder, at en AMU er lig med 1/12 massen af et carbon-12 atom.
* relative sammenligninger: Atommasserne af alle andre elementer bestemmes i forhold til carbon-12. For eksempel, hvis et atom af element X er dobbelt så tungt som et carbon-12-atom, ville dets atommasse være 24 amu.
Mens svovl-32 blev brugt som standard i fortiden, er det ikke længere tilfældet. Carbon-12 blev den accepterede standard for atommasse i 1960'erne.
 Varme artikler
Varme artikler
-
 Væske-lignende bevægelse i krystaller kan forklare deres lovende adfærd i solcellerIllustration af perovskittens krystalstruktur. Molekylerne roterer omkring deres hængsler i to dimensioner, som kunne forklare materialets fotovoltaiske evner. Kredit:Jill Hemman, Oak Ridge National L
Væske-lignende bevægelse i krystaller kan forklare deres lovende adfærd i solcellerIllustration af perovskittens krystalstruktur. Molekylerne roterer omkring deres hængsler i to dimensioner, som kunne forklare materialets fotovoltaiske evner. Kredit:Jill Hemman, Oak Ridge National L -
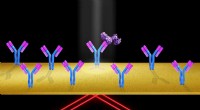 Teknikken tillader praktisk, præcis optisk billeddannelse af individuelle proteinerNår proteinmolekyler (lilla) binder sig til immobiliserede receptormolekyler, (som de Y-formede antistoffer, der er fastgjort til objektglassets overflade), brydningsindekset ved guldoverfladen ændres
Teknikken tillader praktisk, præcis optisk billeddannelse af individuelle proteinerNår proteinmolekyler (lilla) binder sig til immobiliserede receptormolekyler, (som de Y-formede antistoffer, der er fastgjort til objektglassets overflade), brydningsindekset ved guldoverfladen ændres -
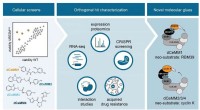 Lægemiddelopdagelse:Første rationelle strategi for at finde molekylære limnedbrydereCellular levedygtighedsskærme nominerede potentielle molekylære lim. Ortogonal undersøgelse af de førende molekyler (dCeMM1/2/3/4) muliggjorde karakterisering af nye molekylære limnedbrydere, der rekr
Lægemiddelopdagelse:Første rationelle strategi for at finde molekylære limnedbrydereCellular levedygtighedsskærme nominerede potentielle molekylære lim. Ortogonal undersøgelse af de førende molekyler (dCeMM1/2/3/4) muliggjorde karakterisering af nye molekylære limnedbrydere, der rekr -
 De stiveste porøse letvægtsmaterialer nogensindePladegitter er det valgmæssige design til fremtidige lette porøse materialer. Kredit:ETH Zürich / Marc Day Forskere ved ETH har udviklet og fremstillet en familie af arkitekturer, der maksimerer s
De stiveste porøse letvægtsmaterialer nogensindePladegitter er det valgmæssige design til fremtidige lette porøse materialer. Kredit:ETH Zürich / Marc Day Forskere ved ETH har udviklet og fremstillet en familie af arkitekturer, der maksimerer s
- Hvornår dannes kemiske bindinger?
- Kortlægning af Armaggedon:Jordens truende tsunamier og megaskælv
- Overmalbar elektronik? Forskere studerer spray-on fremstilling af transistorer
- Hvorfor chefer bør lade medarbejdere surfe på nettet på arbejdet
- Når solen bliver en rød kæmpe, vil den udvide til omtrent dens nuværende radius.?
- Hvad tillader et større bevægelsesområde omkring led?


